HEAT: Képletek, típusok, mintaproblémák (összefoglaló)
Betöltés...
A hőképlet ismerős dolog a fizikaórákon. A hő az energia egyik formája, amelyet egy tárgy képes befogadni vagy kibocsátani. A hőnek joule-nak vagy kalóriának nevezett egységei vannak.
A hő bizonyos anyagok által birtokolt hőenergiaként értelmezhető, és a tárgy hőmérsékletének mérésével érzékelhető. Látható a hő alkalmazása a nyitva hagyott meleg vízben, amely fokozatosan lehűl (már nem melegszik fel), mert a vízből hő szabadul fel a levegőbe.
Tartalomjegyzék
A kalória meghatározása

A hő olyan energia, amely egy magasabb hőmérsékletű tárgyról egy alacsonyabb hőmérsékletű tárgyra tud átjutni, amikor a két tárgy érintkezik vagy összeér. Két különböző hőmérsékletű tárgy hőáramlást és mozgást okoz.
Például, ha meleg és hideg vizet kever, az egyesülő vízből meleg víz lesz. Azt is meg kell értened, hogy a hőmérséklet és a hő két különböző dolog. A hőmérséklet hőmérővel mérhető érték, a hő pedig áramló energia.
A nemzetközi rendszer (SI) vagy MKS szerint a hő mértékegysége Joule (J), míg a CGS szerint a hő mértékegysége erg. Számos ételtípusnál a hő a kalóriaegységet használja.
Egy kalóriát úgy definiálunk, mint azt a hőenergia-mennyiséget, amely 1 gramm víz hőmérsékletének 1 Celsius-fokra emeléséhez szükséges. Tehát arra a következtetésre juthatunk, hogy 1 kalória = 4,184 Joule vagy általában közvetlenül 4,2 J-re kerekítve.
Kalória képlet
A hőnek fentebb olvasott definíciója szerint az alábbiakban felsorolunk néhány képletet, amelyeket a fizika tantárgyak hőanyagára vonatkozóan foglaltunk össze.
1. Hőátadási képlet
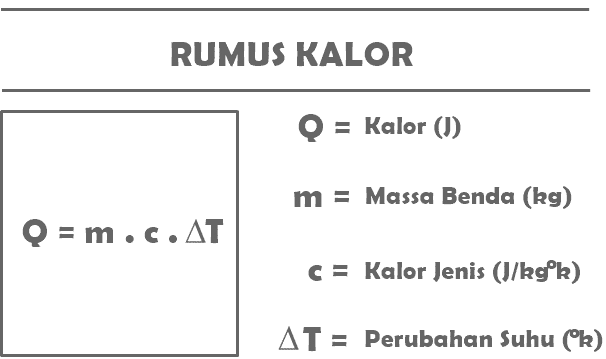
Q = m. c. T
Val vel:
Q = egy bizonyos tárgy által kapott vagy leadott hőmennyiség (J)
m = a hőt fogadó vagy kibocsátó tárgy tömege (kg)
c = az anyag fajhője (J/kg°C)
T = hőmérsékletváltozás (°C)
2. Fajlagos hő képlet
Ennek a képletnek a mércéje a hőátadási képlet, a c elem (az anyag fajhője) eltávolításával a szokásos módon matematikailag számítandó.
c = Q/(m. T)
Val vel:
c = az anyag fajhője (J/kg°C)
Q = egy bizonyos tárgy által kapott vagy leadott hőmennyiség (J)
m = a hőt fogadó vagy kibocsátó tárgy tömege (kg)
T = hőmérsékletváltozás (°C)
3. Hőkapacitási képlet
C = Q/T
Val vel:
C = hőkapacitás (J/°K)
Q = sok hő (J)
T = hőmérsékletváltozás (Kelvin / K)
4. Képlet a hőkapacitás meghatározásához
C = m. c
Val vel:
C = hőkapacitás (J/°K)
m = a hőt fogadó vagy kibocsátó tárgy tömege (kg)
c = az anyag fajhője (J/kg°K)
5. Olvadáshő és gőzképlet
Az olvadáshő képlete a következő.
Q = m. L
A gőzhő képlete a következő.
Q = m. U
Val vel:
Q = sok hő (J)
m = a tárgy tömege (kg)
L = olvadási hő (J/kg)
U = az anyag gőzhője (J/kg)
Olvas: Termodinamika
A kalória típusai

Számos hőfajtát különböztetnek meg az adott anyagban végzett munkafolyamat alapján. Az alábbiakban felsoroljuk azokat a hőfajtákat, amelyeket meg kell értenie ahhoz, hogy megismerje a mindennapi életben való alkalmazását.
1. Képződési hő (ΔHf)
A képződéshő az a hő, amely keletkezik vagy szükséges ahhoz, hogy 1 mól vegyületet képezzenek elemeiben, például gázokban, amelyeket a molekulaképlettel írnak le. A képződéshő néhány példája a C12, O2, Br2, H2.
2. Bomláshő (ΔHd)
A bomláshő a hő azon formája, amely 1 mól vegyület másik elemmé történő lebontásához keletkezik vagy szükséges.
3. Égéshő (ΔHc)
Az égéshő egy mól anyag, például elem vagy vegyületének elégetéséhez nyert vagy szükséges hő.
4. Semlegesítési hő (ΔHn)
A semlegesítési hő az a hőtípus, amelyet egy mól H képzéséhez nyerünk vagy szükséges2O sav és bázis reakciójából. Ez a hő egy exoterm reakció, mert hőmérsékletnövekedik.
5. Oldáshő (ΔHs)
Az oldódási hő az a hőtípus, amely az eredetileg szilárd anyag 1 móljának oldatba való feloldásához keletkezik vagy szükséges.
Olvas: Sűrűség képlet
Fajlagos hő és hőkapacitás
Azt is tudni kell, hogy hő áramolhat két olyan anyagban, amelyeknek különböző részecskéi vannak, és eltérő a hőmérséklet-változása. Például, ha a vizet és az olajat azonos hőmérsékletre hevítik, az olaj hőmérséklete jobban változik, mint a víz hőmérséklete.
Ez azért fordulhat elő, mert két különböző típusú hő van, amelyeket összehoznak vagy összeraknak. A fajhő az a hőmennyiség, amely szükséges ahhoz, hogy a hőmérsékletet 1 kg tömegről 1 °C-ra emeljük, mértékegysége kalória/gramm °C vagy J/kg °C.
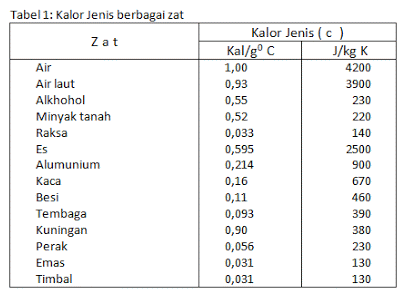
Minden anyagnak megvan a maga fajlagos hője, és ebben vannak különbségek. Eközben a hőkapacitás fogalma azt a hőmennyiséget jelenti, amely szükséges vagy elnyelt egy tárgy hőmérsékletének 1 °C-ra emeléséhez.
Hőcsere
Alkalmazása során a hőformula azon az elven működik, amely megváltoztatja a két egymáshoz vagy egymással érintkező anyagot. Az alábbiakban egy hőváltozást mutatunk be, amely akkor következik be, ha vannak olyan anyagok, amelyeket összeraknak vagy összehoznak.
1. A hő megváltoztathatja az anyag hőmérsékletét
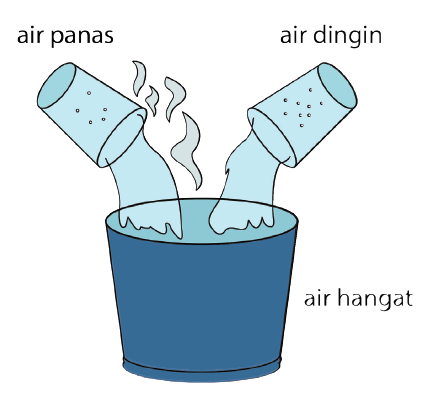
Minden alapvető objektum hőmérséklete alacsonyabb, mint az abszolút nulla, ezért az objektumnak hőnek kell lennie. Ez a tartalom később meghatározza, hogy az objektum mennyi hővel rendelkezik.
Amikor a tárgy felmelegszik, további hőt kap. A hőmérséklet is növekedni vagy emelkedni fog. Ezzel szemben, ha a tárgy lehűl, akkor hő szabadul fel, és a hőmérséklet csökkenését okozza.
2. A hő megváltoztathatja az anyagokat

Bizonyos típusú objektumoknál, ha bizonyos mértékegységekben hőt adnak, az objektum állapotváltozáson megy keresztül. Például, ha a jégnek hőt adnak (hevítik), akkor a jég alakja szilárdból folyékony vagy akár gáz halmazállapotúvá változik.
Ha a hevítési folyamatot folyamatosan hajtják végre, ez az, ami miatt a víz visszaváltozik anyaggá. Ez akkor fordul elő, amikor az alakot megváltoztatni készülő tárgy a folyadék pontjáról a tárgy olvadáspontjára kerül.
A hőátadás típusai
A hő meghatározásának, fajtáinak, képleteinek, a hőváltozások magyarázatának áttanulmányozása után arra a következtetésre juthat, hogy a hő akkor is mozoghat, amikor más tárgyakkal találkozik vagy érintkezik. Az alábbiakban bemutatunk néhány hőátadási típust.
1. Vezetés

A vezetés általi hőátadás akkor következik be, amikor egy köztes anyagon, például fémen halad át, de ezt nem követi az anyagban lévő részecskék állandó mozgása. Például, amikor egy fém egyik végét felmelegítjük, a fém másik vége is felforrósodik.
Ez annak köszönhető, hogy a hőt magas hőmérsékletről alacsonyabb hőmérsékletre vezetik. A felmelegített fémhegy hatására a fémrészecskék rezgéseket keltenek a hozzájuk kapcsolódó többi részecskében.
Ezért minden fémrészecske vibrál még akkor is, ha a fémnek csak az egyik végét melegítik, ami aztán hőátadást okoz. Egy másik példa, amikor a motorkerékpár kipufogója forró a motor bekapcsolásakor.
Vezetés akkor is előfordul, ha tűzön tartja a tűzijátékot, megfogja az edény fedelét, amely a főzés során forrónak érződik, a melegítéskor megolvadó vajat és így tovább. A vezetési hőátadás képlete a következő.
Hőteljesítmény = Q/t = kA. T / x
2. Konvekció
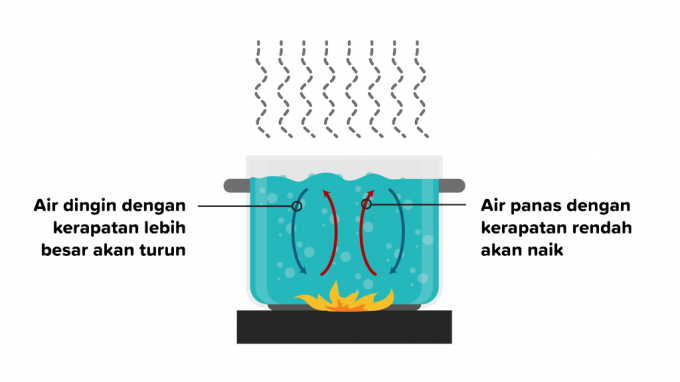
A konvekció olyan hőátadás, amelyben a hő áthalad egy anyagon, és ezt követi az anyag egyes részei. A konvekciós hőátadás folyadékokban vagy gázokban történhet, ezért a konvekciót a következőképpen osztjuk két részre.
a. Tudományos konvekció
A konvekció olyan hőátadás, amely külső tényezők nélküli felhajtóerő hatására jön létre, és különböző típusú tárgyak befolyásolják. Példa arra, hogy víz melegítésekor a forró víz részecskéinek sűrűsége eltávolodik a tűztől, majd egy alacsonyabb hőmérsékletű vízanyag helyettesíti.
b. Kényszerített konvekció
Hirdetés
A konvekció olyan hőátadás, amelyet külső tényezők, például nyomás hatására idéz elő úgy, hogy az átadás szándékosan vagy kényszerből történik. Vagyis a hő kénytelen egy helyre költözni a segítség miatt.
Példák az esetekre, amikor egy ventilátor hideg levegőt bocsát ki egy melegnek tűnő helyre, a motor hűtőrendszere az autó hűtőjén stb.
A konvekció másik alkalmazása vízmelegítéskor történik, ahol a víz fel és le mozog, zöldbab magvak ami felforr és süllyed, a szárazföldi és tengeri szellő folyamata, a hőlégballonok mozgása, a kéményfüst gyár.
A konvekciós hőátadás képlete a következő.
Hősebesség = Q/t = hA. T
3. Sugárzás

A sugárzás hőátadás, amelyhez nincs szükség köztes anyagra vagy közegre. A hőátadás a sugárzásban nem azonos a vezetéssel és a konvekcióval. A sugárzásban bekövetkező elmozdulás nem mindig hozza érintkezésbe vagy találkozik a két anyag között, mert a hő közvetítő nélkül is képes átadni.
Azaz a hőt maga a hőforrás fogja minden irányba kisugározni, majd minden elérhető irányba áramlik. Alapvetően minden tárgy képes hősugárzást kibocsátani és elnyelni, de a mennyiség az anyag hőmérsékletétől és színétől függ.
Minél melegebb egy tárgy, mint a körülötte lévő hőmérséklet, annál több hőt sugároz a környezetébe. Tehát, ha egy forró tárgy felülete nagyobb, akkor a kisugárzott hő melegebb lesz.
Példa a sugárzási esetekre a mindennapi életben, ha máglyát raksz, akkor meleg lesz Mivel a tűzforrás bizonyos távolságra van, a sugárzás akkor érződik, amikor a tenyér felmelegszik, amikor közelítik tűzzel. A sugárzás hőképlete a következő.
Hőteljesítmény = Q/t = eσAT4
4. Hőszigetelés

A hő könnyen átadható. Megakadályozhatja a mozgást, legyen az vezetés, konvekció vagy sugárzás. Például a helyiség elszigetelésével; A termosz képes melegen vagy melegen tartani a víz hőmérsékletét, így megakadályozható a hőátadás.
Olvas: Gázanyag
Példa a kalória problémára

A hőképlet egy olyan módszer, amellyel a következő kérdéspéldákon dolgozhat!
1. 1. példakérdés
Egy tárgy hőmérséklete 5°C, és 1500 J hőt nyel el. A tárgy hőmérséklete 32°C-ra változik. Számítsa ki az objektum hőkapacitását!
Megoldás:
Q = 1500 J
T = 32°C – 5°C = 27°C = 300°K
C = Q/T
C=1500/300
C = 5 J/°K
2. 2. példakérdés
Számítsa ki 5 kg víz 25°C-os 105°C-os felmelegítéséhez szükséges hőmennyiséget, ha ismert, hogy a víz fajhője 1000 J/kg°C!
Megoldás:
m = 5 kg
c = 1000 J/kg°C
T = 105°C – 25°C = 80°C
Q = m. c. T
Q = 5. 1000. 80
Q = 400 000 J
3. 3. példakérdés
Ha egy víz tömege 3 kg, és 30°C-ról 100°C-ra melegítjük, és a fajhője 1 J/g°C, számítsa ki a vízhez szükséges hőmennyiséget!
Megoldás:
m = 3 kg
c = 1 g/°C = 1000 J/kg°C
T = 100°C – 30°C = 70°C
Q = m. c. T
Q = 3. 1000. 70
Q = 210 000 J
4. 4. példakérdés
Egy folyadék tömege 5 kg. A folyadék 200 000 J hőt igényel, és 20 °C-ról 80 °C-ra melegszik. Számítsa ki a folyadék fajhőjét!
Megoldás:
m = 5 kg
Q = 200 000 J
T = 80°C – 20°C = 60°C
c = Q/m. T
c = 200 000 / 5. 60
c = 200 000 / 300
c = 666,67 J/kg°C
5. 5. példakérdés
Egy alumínium tömege 5 kg. A kezdeti hőmérséklet 25°C. Ha az alumínium 250 000 J hőt kap és fajhője 900 J/kg°C, számítsa ki az alumínium végső hőmérsékletét!
Megoldás:
m = 5 kg
Q = 250 000 J
c = 900 J/kg°C
T1 = 25 °C
Q = m. c. T
250.000 = 5. 900. (T2 – 25)
T2 – 25 = 250.000 / 5. 900
T2 – 25 = 250.000 / 4.500
T2 – 25 = 55,56
T2 = 55,56 + 25 = 80,56 °C
6. 6. példakérdés
Van 300 gramm víz hőmérséklete 25 ° C, fel kell melegíteni energiával 1500 kalóriát. Ha a víz fajhője 1 cal/g°C, számítsa ki a víz hőmérsékletét felmelegedés után!
Megoldás:
m = 300 gramm
T1 = 25 °C
c = 1 cal/g°C
Q = 1500 kal
Q = m. c. T
1.500 = 300. 1. (T2 – 25)
T2 – 25 = 1500 / 300. 1
T2 – 25 = 5
T2 = 5 + 25 = 30 °C
7. 7. példakérdés
300 gramm vizet kell 40°C-ról 65°C-ra melegíteni. Ha a víz fajhője 1 cal/g°C vagy 4200 J/kg°K, számítsa ki:
- Sok hőt kapnak kalóriában
- Mennyi hő érkezik Joule-ban
Megoldás:
m = 300 g = 0,3 kg
T = 65-40 = 25°C
c = 1 cal/g°C = 4200 J/kg°K
- Kalória kalóriában
Q = m. c. T
Q = 300. 1. 25
Q = 7500 kalória
- Hőmérséklet joule-ban
Q = m. c. T
Q = 0,3. 4.200. 25
Q = 31 500 kalória = 132 300 Joule
A fenti magyarázat alapján a hőképlet nem csak az elengedés és az igénylés körül forog hő, de változás történik a hőben, a hőátadásban, sőt az egyes anyagok fajhőjében is, amely változnak. Jó gyakorlást és remélem hasznos lesz ez a cikk!
X ZÁRVA
Reklámok
HIRDETÉS
X ZÁRVA
