Kvantumszámos anyag: típusok, példaproblémák (összefoglaló)
Betöltés...
Egyszerűen elmagyarázva a kvantumszám az elektronok helyzetét és az energiaszinteket leíró szám, ill a távolság az atommagtól egyszerre, a pályák alakja, a pályák orientációja és az elektronok spinje, amelyet a mechanikai atommodell tartalmaz Kvantum.
Minden atomnak van egy pályája, és az atompályák különböző energiaszintekkel rendelkeznek. Ugyanannak a pályának az energiaszintje eltérő lesz, ha az atomok különbözőek, ezért a hidrogén 1s pályája energiaszintben különbözik a hélium 1s pályájától.
Tartalomjegyzék
A kvantumszámok meghatározása

A hullámfüggvényben ennek a számnak speciális jelentése van a kvantumhelyzet állapotának leírására. Ezek a számok leírhatják az elektronok állapotát az atomban. 1926-ban Erwin Schrodinger javasolta a kvantummechanika elméletét.
Ez az elmélet megmagyarázza az atom szerkezetét. Ezt a kvantummechanikai atomi modellt egy matematikai egyenlet fejezi ki, nevezetesen a hullámegyenlet. A hidrogénatom egyenletének megoldása hullámfüggvényt vagy atompályát eredményez.
Ez az atompálya leírja az atomban lévő elektronok kvantumszámának helyzetét. A hullámfüggvény négyzete azt jelenti, hogy nagy a valószínűsége annak, hogy az atommag körül egy adott térfogatú térben elektron kerül.
A Heisenberg-féle bizonytalansági elvhez hasonlóan az elektronok helyzete az atomokban nem határozható meg. Csak azt lehet tudni, hogy az elektron a legnagyobb valószínűséggel hol található.
A kvantumszámok típusai
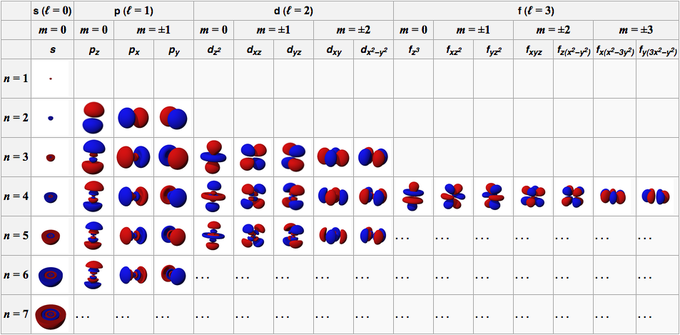
Az atom pályája a pályát alkotó hullámfüggvényekből jön létre. Általános körülmények között egy atom pályakarakterisztikáját négy szám írja le, nevezetesen n, l, m és s.
1. Főkvantumszám (n)
Ez a szám 1-től (egy) kezdődő pozitív egész számokból áll, így n értéke 1, 2, 3, 4, 5 és így tovább. Ez a szám az atomban lévő pálya által elfoglalt héjra vonatkozik.
2. Azimutkvantumszám (l)
Ez a szám 0-tól (nulla) kezdődő pozitív egész számokból áll, így az l értéke 0, 1, 2, 3, 4, 5 stb. Ezeknek a számoknak saját jelük van; 0 az s pálya, 1 a p pálya, 2 a d pálya és 3 az f pálya.
3. Mágneses kvantumszám (m)
Ez a szám 0 (nulla) és +/- 1 közötti egész számokból áll, így az egyes pályákhoz tartozó számértékek nem azonosak. Az s pályára akkor m 0, mert az s pályán van, akkor l 0. Azon d pályákon azonban, ahol l értéke 2, akkor m értéke -2, -1, 0, 1 és 2.
4. Pörgetési kvantumszám(ok)
Ha az előző szám a pályák orientációját jelzi, akkor ez a szám az elektron spinjét írja le, amelynek értéke 1/2 és -1/2.
Olvas: Kvantummechanika
Pályák és kvantumszámok
Minden atompályának három kvantumszámból álló egyedi halmaza van. Ezek a számok a főkvantumszám (n), azimut vagy szögimpulzus (l) és a mágneses (m). Ez a három szám több dolgot illusztrál.
Ezek közé tartozik a pályák energiaszintjének, méretének, alakjának és az atompályák lehetséges radiális eloszlásának orientációjának leírása. Aztán ott van a spin szám (s), egy szám, amely megmondja az elektron spinjét egy pályán.
Atompálya alakja
Az azimutszám értékei alapján az atompályáknak négy formája van. A négy pályaforma a következő.
1. s pályák
Az s pálya egy olyan pálya, amelynek l = 0. Gömb alakú, közepén az atommaggal. Mivel a gömbnek csak egy tájolása van, minden S pályának csak egy m értéke van, azaz m = 0. Az 1s pályán van a legnagyobb elektronsűrűség vagy -sűrűség az atommagban.

Az atomsűrűség ezután lassan csökken, ahogy távolodik az atommagtól. A 2s pályán két nagy elektronsűrűségű tartomány van. A két régióból van egy gömb alakú csomópont, ahol az elektronokkal való találkozás valószínűsége abban a tartományban nullára csökken.
A növekvő s orbitális csúcsok mintája folytatódik a 4-es, 5-ös és így tovább.
2. p. pályák
A p pálya egy olyan pálya, amelynek l = 1. A forma olyan, mint egy csavart léggömb, két lebenylel felszerelve. A lebenyek az atommag ellentétes oldalán helyezkednek el. Az atommag a p orbitális csomópont síkjában, a két nagy elektronsűrűségű lebeny között van.

A p pályának háromféle térbeli orientációja van, nevezetesen Px, Py és Pz, így m-nek három lehetséges értéke van, nevezetesen -1, 0 vagy +1. A három orbitál egymásra merőlegesen helyezkedik el az x, y és z tengelyen derékszögű koordinátákban. A forma, a méret és az energia ugyanaz.
3. d orbitális
A d pálya egy olyan pálya, amelynek l = 2. Ennek a pályának öt különböző tájolása van, így öt lehetséges m értéket kap, nevezetesen -2, -1, 0, +1 vagy +2. A négy d pályája a dxy, dxz, dyx és d2-y2.
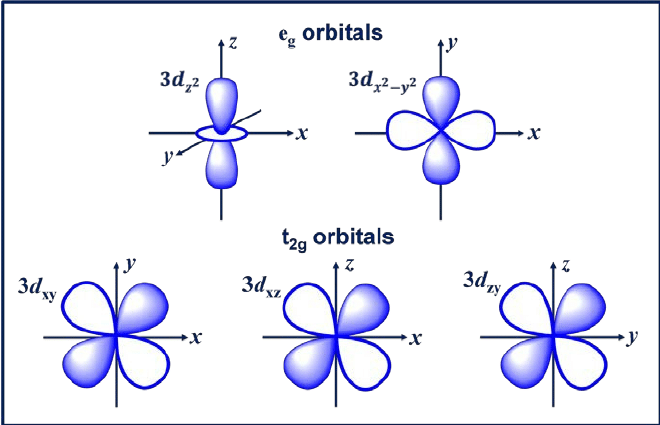
Ezeknek a pályáknak négy lebenye van, amelyek lóhere alakúak. A következő d pálya a dzw, amelynek a z tengelyén két fő lebeny található, középen pedig egy fánk alakú szakasz.
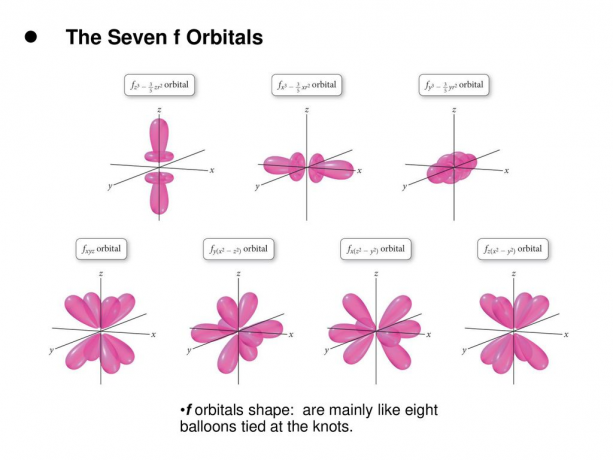
4. f) pályák
Az f pálya egy olyan pálya, amelynek l = 3. Ennek a pályának hétféle tájolása van, ahogyan az m-nek hét lehetséges értéke (2l + 1 = 7). Minden f orbitál összetett alakú, változó számú lebenyekkel.
Olvas: Elektron konfiguráció
Elektron konfiguráció
Miután megértette, hogy a kvantummechanika atomelméletében milyen összefüggés van az elektronok atomokban való létezése és a pályák között, Ezután megtanulja az elektronkonfigurációt, az elektronok elrendezését az atomburokban lévő pályákon többelektronos.
1. Aufbau szabálya
Hirdetés
Ebben a szabályban az szerepel, hogy az elektronokat alacsonyabbról magasabb energiaszintről kell feltölteni. A pályák energiaszintjeit a Kémiai Elemek Periódusos Rendszerében az atomok elrendezésében láthatjuk.
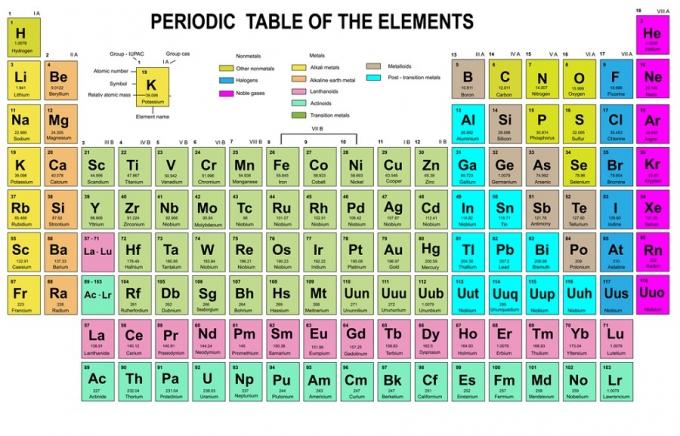
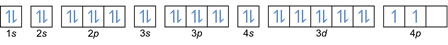
A táblázatban a bal alsó sarokban pirossal van írva, ahol egy s blokk van, a kék a d, a sárga a p, a zöld pedig az f. Míg minden sor egy bőr.
Az elrendezés alapján láthatja, hogy az energiaszintek sorrendje 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p stb.
2. Hund szabályok
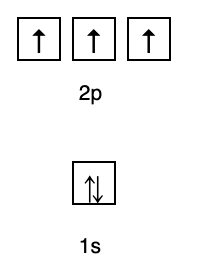
Ez a szabály kimondja, hogy ha vannak azonos energiaszintű pályák, akkor az elektronoknak kell lenniük párhuzamosan töltjük, amíg az azonos energiaszinten lévő összes pálya meg nem telik elektronokkal, amint az ábra mutatja következő.
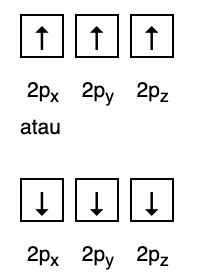
Mindeközben a következő ábra nem felel meg a Hund szabálya szerinti kitöltéshez.
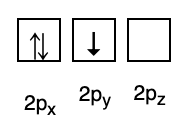
3. Pauli eltiltása
A Pauli-tilalom kimondja, hogy az elektronok nem rendelkezhetnek azonos kvantumszámmal egy pályára töltve, ezért van egy spinszám(ok), amelyek értéke +1/2. A legalacsonyabb energiájú az, amelyikben a legtöbb párosított elektron és párhuzamos spin van.
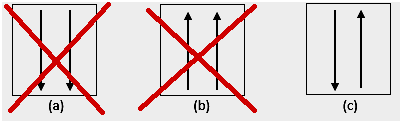
4. Rendellenesség

Kísérletek szerint a fent említett szabályok szerint anomáliák vannak az elektronkonfigurációban. A d alhéj általában félig vagy tele van. Például azért 24A Cr, elektronkonfigurációja: [Ar] 4s1 3d5, stabilabb, mint az [Ar] 4s2 3d4.
Ezenkívül az elektronkonfiguráció a 29Cu: [Ar] 4s1 3d10, stabilabb, mint az [Ar] 4s2 3d9. Eközben az olyan monoatomi ionok elektronkonfigurációja, mint a K+, Na+, Ca2+, Br–, S2-, és így tovább, először a semleges atom határozza meg.
Pozitív töltésű kationok vagy ionok esetén a monoatomi Ax+ x+ töltéssel, akkor az A semleges atom külső elektronhéjáról akár x elektron is lekerül. Ami az aniont illeti, a monatomi By- y töltéssel annyi elektront fogunk be a legalacsonyabb energiájú pályán, amely még nem telt meg.
Hogyan határozzuk meg a kvantumszámokat
A szám meghatározása előtt először meg kell alkotnia annak az elemnek az elektronkonfigurációját, amelynek kvantumértékét meg szeretné keresni. Például van 16S. Elektronkonfigurációja 1s2 2s2 2p6 3s2 3p4. Ezt követően vegyük az utolsó elektronkonfigurációt, ami 3p4.
- Ezen konfiguráció alapján a fő számérték 3, mivel a 3-as szám a pálya vagy héj méretét jelöli.
- p az elektron egy részhéja, így l = 1 értéke alatt kapható meg.
- Mivel a p alhéjban van, a kvantumszám -1, 0 vagy +1 között lesz. Ennek meghatározásához először rajzolja meg az orbitális dobozt. A doboz kitöltésekor használhatja a nyilakat.
- Töltse ki az egyes mezőket felfelé mutató nyíllal, majd töltse ki egy lefelé mutató nyíllal. A 4-es szám azoknak a nyilaknak a száma, amelyeket ki kell tölteni, hogy így megkapjuk.
↑↓ ↑ ↑
-1 0 +1
- A negyedik (utolsó) nyíl a -1 mezőben található, ahol a mechanikai érték m = -1.
- A felfelé mutató nyíl +1/2, míg a lefelé mutató nyíl -1/2. Az utolsó nyíl a lefelé mutató nyíl, tehát az s értéke -1/2.
Nos, így kell meghatározni a kvantumszámot. Íme néhány példa az anyaggal kapcsolatos kérdésekre, amelyeket tanulmányozhat.
Olvas: Fizikai változás
Példák kvantumszámokra

Tekintse meg az alábbi kérdéseket!
1. 1. példakérdés
Határozza meg az alábbi elemek és egyatomos ionok elektronkonfigurációit és elektrondiagramjait!
- 8O2-
- 20Mg2+
- 26Fe3+
- 27Co
- 32Ge
Megoldás:
- Elektron konfiguráció 8O2:1s2 2s2 2p4 vagy [Ő] 2s2 2p4
Elektron konfiguráció 8O2–: 1s2 2s2 2p6 vagy [Ő] 2s2 2p6 vagy [Ne] (plusz 2 elektron: 2s2 2p4+2)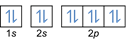
- Elektron konfiguráció 20Mg: 1s2 2s2 2p6 3s2 3p6 4s2 vagy [Ar] 4s2
Elektron konfiguráció 20Mg2+: 1s2 2s2 2p6 3s2 3p6 vagy [Ar] (levonjunk 2 elektront a külső héjból: 4s2-2)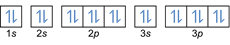
- Elektron konfiguráció 26Fe: 1s2 2s2 2p6 3s2 3p6 4s2 3d6 vagy [Ar] 4s2 3d6
Elektron konfiguráció 26Fe3+: 1s2 2s2 2p6 3s2 3p6 3d5 vagy [Ar]3d5 (Vonjunk le 3 elektront a külső héjból: 4s2-2 3d6-1)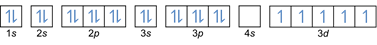
- Elektron konfiguráció 27Co: 1s2 2s2 2p6 3s2 3p6 4s2 3d7 vagy [Ar] 4s2 3d7
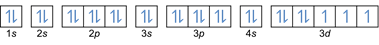
- Elektron konfiguráció 32Ge: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p2 vagy [Ar] 4s2 3d10 4p2
2. 2. példakérdés
A Ga-ban lévő utolsó elektronnak kvantumszáma van...
- n=4; l = 0
- n=4; l = 1
- n=3; l = 2
- n=4; l = 2
- n=3; l = 1
Megoldás:
Ha megnézzük az elemek kémiai periódusos rendszerét, a Ga elem a IV. periódusban van, így n = 4. A gallium a 13. csoportba tartozik, tehát a vegyértékelektronok a p alhéjban vannak, vagyis l = 1.
3. 3. példakérdés
Az alábbiakban az a kvantumszám, amelyet a Cl atom utolsó elektronja nem foglalhat el, a...
- n=3; l = 1; m = -1; s = -1/2
- n=3; l = 1; m = 0; s =
- n=3; l = 2; m = -1; s =
- n=3; l = 2; m = 1; s = -1/2
- n=3; l = 1; m = 1; s = 1/2
Megoldás:
Mivel a Cl elem a 3. periódusban van, akkor n = 3. A Cl is egy 17-es csoport, tehát vegyértékelektronjai a p részhéjban vannak, tehát l = 1. Az m értéke -1, 0 vagy +1 lehet, mert a három kvantumszám energiája megegyezik, és a kitöltés sorrendje nem számít.
Mert s is érhet -1/2 vagy 1/2, így m-t és s-t nem tudjuk biztosan meghatározni.
4. 4. példakérdés
Egy X elem3+ azonos elektronkonfigurációval rendelkezik, mint az Ar elem. Tehát az ion, amelynek konfigurációja megegyezik az ionéval...
- K+
- Mg2+
- Na+
- Cl+
- F–
Megoldás:
Az Ar elem a 3. periódusban van, tehát az ion ugyanolyan elektronkonfigurációjú, mint az Ar vagy [Ne] 3s2 3p6 a kationok esetében a 4. periódusban, az anionok esetében pedig a 3. periódusban lesz. A legmegfelelőbb ion a K+.
5. 5. példakérdés
Határozza meg az elem kvantumszámát! 32Ge!
Megoldás:
Elektron konfiguráció 32Ge: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p2 vagy [Ar] 4s2 3d10 4p2.
Az utolsó konfiguráció 4p2. Az energiaszint 4, és a p részhéjban van, tehát n = 4 és l = 1. 4p pályadiagram rajz2 a többi szám megismeréséhez az alábbiak szerint.
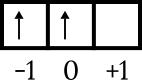
Az utolsó elektron a 0 dobozpályán van, a nyíl felfelé mutat, tehát m = 0 és s = +1/2.
6. 6. példakérdés
A következők mindegyike megengedett kvantumszám, kivéve...
- n=2; l = 1; m = -1
- n=3; l = 2; m = 1
- n=3; l = 3; m = -1
- n=3; l = 0; m = 0
- n=3; l = 2; m = -1
Megoldás:
Ha a főszám (n) értéke 3, akkor a maximális azimutszám (l) n-1 = 3-1 = 2. Ezért a C opciók, ahol n = 3, l = 3 és m = -1, nem megengedettek.
A kvantumszámok megtanulásához el kell sajátítania a gyakran használt vagy problémákban megjelenő elemek atomszámait is. Ezenkívül ismernie kell az energiaszintek elrendezését, amikor elektronkonfigurációkat készít.
X ZÁRVA
Reklámok
HIRDETÉS
X ZÁRVA
