Molaritási és molalitási képletek és példaproblémák
Betöltés...
Az oldat kolligatív jellege a XI. osztályú SMA vegyi anyagok közé tartozik. Ennek az anyagnak a megértéséhez jól el kell sajátítania az oldat molaritási és molalitási képleteit, mivel ez a fejezet szorosan összefügg az oldat koncentrációjával.
Azok számára, akik nem tudják, az oldat oldószerek (általában víz vagy H) homogén keveréke.2O) az oldott anyaggal. Annak érdekében, hogy könnyebben megértse ezt az anyagot, itt bemutatjuk azt a megértéstől a megoldások molaritásával és molalitásával kapcsolatos kérdésekre vonatkozó példákig.
Tartalomjegyzék
A molaritás megértése

A molaritás az oldhatóság mértéke, amely az oldott anyag mólszámát fejezi ki az oldat térfogatára vonatkoztatva. A molaritás szimbóluma az M (nagy) jelölés, ahol a moláris egységek mol/liternek felelnek meg.
Olvas: Savbázis
Molaritási képlet

Ha korábban a molaritás megértése volt, akkor mi a helyzet a képlettel? Nos, itt a molaritási képlet:
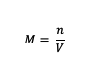
M = az anyag molaritása (moláris vagy mol/l)
n = egy anyag móljai (mol)
V = az oldat térfogata (ml)
A fenti képlet mellett a molaritást a következő képlet segítségével is kiszámíthatja:
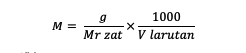
M = az anyag molaritása (moláris vagy mol/l)
g = az anyag tömege (gramm)
Mr = az anyag relatív molekulatömege (gramm/mol)
V = az oldat térfogata (ml)
Ha az oldatot összekeverjük, a képlet érvényes:
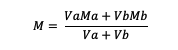
Va = az a anyag térfogata
Vb = b anyag térfogata
Ma = az anyag molaritása a
Mb = a b anyag molaritása
Ha az oldatot hígítottuk, akkor az alkalmazandó molaritási képlet a következő:
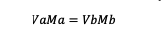
Va = az a anyag térfogata
Vb = b anyag térfogata
Ma = az anyag molaritása a
Mb = a b anyag molaritása
A mólérték meghatározásához az alábbi képlet segítségével kell kiszámítani:
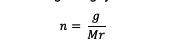
n = egy anyag móljai (mol)
g = az anyag tömege (gramm)
Mr = az anyag relatív molekulája (gramm/mol)
A molalitás definíciója

Első pillantásra hasonló, de eltérő molaritású tudod molalitással!
A molalitás vagy moláris koncentráció az oldott anyag móljainak száma egy kilogramm oldószerben. Definíció szerint a molalitás egy olyan mennyiség, amely megadja az oldott anyag móljainak számát az oldószer egységnyi tömegére vonatkoztatva. A molalitást m (kicsi) jelöléssel jelöljük.
Olvas: Ohm törvénye
Molality Formula

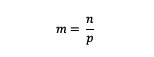
m = egy anyag molalitása (molalitás)
n = egy anyag móljai (mol)
p = az oldószer tömege (gramm)
Ezenkívül a molalitást a következő képlet segítségével is kiszámíthatja:
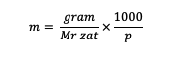
m = egy anyag molalitása (molalitás)
Mr = az anyag relatív molekulája (gramm/mol)
p = az oldószer tömege (gramm)
A molaritási és molalitási képletek közötti különbség
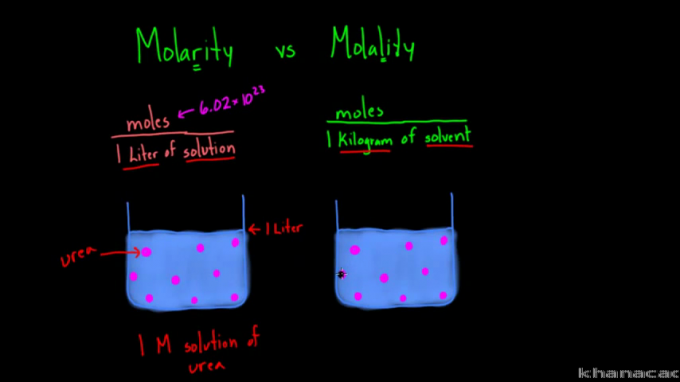
A „molaritás” és „molalitás” kifejezések gyakran zavarba ejtenek néhány embert hasonló írásuk és kiejtésük miatt. Bár mindkettőt használják az oldat koncentrációjának mérésére, vannak különbségek a kettő között.
A fenti képlet alapján látható, hogy a molaritás és a molalitás közötti különbség a megközelítésben rejlik. A molaritás vagy moláris koncentráció egy anyag mólszámát méri literenként. Míg a molalitás azt méri, hogy egy anyagnak hány mólja van egy kilogramm oldószerben.
Hirdetés
Olvas: Üzleti képlet
Példák molaritási problémákra és megbeszélésre

Most, miután ismeri a molaritás és molalitás képletét, jobb lenne, ha azonnal megpróbálna dolgozni a problémán, hogy jobban megértse az anyagot. Gyerünk, csak tegye meg a következő kérdéseket!
A molaritás problémája
1. Ha ismert, hogy az oldott anyag tömege 11 gramm, akkor az oldat térfogata 500 ml, Mr = 22. Mi a molaritás?
Válasz:
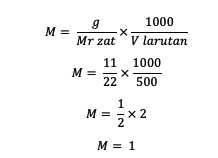
Tehát az anyag molaritása 1 mol/L.
2. 20 ml térfogatú 5 M HCl-t 0,4 M-re hígítottunk. Tehát mennyi vizet kell hozzáadni az oldathoz?
Válasz:
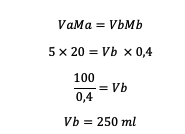
Tehát a hozzáadandó víz mennyisége 250 ml.
3. Glükóz (C6H12O6), amelynek relatív tömege 180, 500 ml 0,1 M glükóz oldatban van jelen. mekkora a glükóz tömege?
Válasz:

Tehát a glükóz által birtokolt tömeg (C6H12O6) 9 gramm.
4. Mekkora az oldószer térfogata H oldatban?2ÍGY4 0,2 M, amelynek oldott anyaga 0,3 mol?
Válasz:
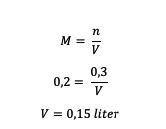
Tehát az oldószer térfogata 0,15 liter.
5. Összesen 18 gramm glükóz (C6H12O6) ahol Mr = 180, feloldjuk vízben úgy, hogy a térfogata 0,5 liter legyen. Mekkora az oldat molaritása?
Válasz:

Először is számítsa ki a mólok számát
Ezután számítsa ki a molaritás értékét.
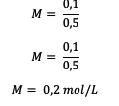
Tehát a glükózoldat molaritása 0,2 mol literenként.
6. 100 ml 01, M NaOH oldat elkészítéséhez hány gramm NaOH-t (Mr = 40) kell feloldani?
Válasz:

Tehát 0,4 gramm szükséges NaOH tömegre van szükség.
Molalitás probléma
1. Ismeretes, hogy egy oldat tömege 11 gramm oldott anyag, 200 gramm oldószer, és Mr = 22. Szóval, mi a molalitás?
Válasz:
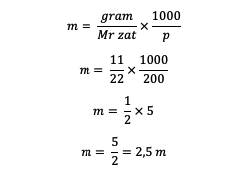
Így 2,5 m molalitást kapunk.
2. Összesen 250 gramm vizet adunk 17,1 gramm nádcukor-oldathoz, amelynek Mr = 342. Mi az oldat molalitása?
Válasz:

Tehát az oldat molalitása 0,2 m.
3. Mekkora a molalitása 4 gramm NaOH-nak (ha ismert, hogy Ar Na = 23, O = 16, H = 1) 250 gramm vízben oldva?
Válasz:
A molalitás kiszámítása előtt először ki kell számítanunk a relatív tömeget.
Mr = 23 + 16 + 1 = 40 gramm/mol
Ezek után számoljuk ki a molalitást.
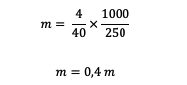
Tehát a NaOH-oldat molalitása 0,4 m.
4. Mekkora a 37%-os HCl-oldat molalitása, ha ismert, hogy Ar H = 1 és Ar Cl = 35,5 ?
Válasz:
Mr = 1 + 35,5 = 36,5 gramm/mol
HCl tömege = 37% x 100 gramm = 37 gramm
Az oldószer tömege = az oldat tömege – a HCl tömege
Az oldószer tömege = 100-37 gramm
Az oldószer tömege = 63 gramm vagy 0,063 kilogramm
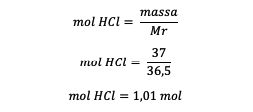
A HCl móljainak ismerete után számítsa ki a molalitást
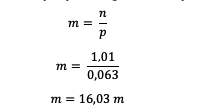
Így látható, hogy a HCl molalitása 16,03 mol.
5. Mennyi a molalitása 15 gramm karbamid CO(NH .?)2)2 250 gramm vízben feloldva? (Mr = 60)
Válasz:
Először számítsa ki a karbamid mol mennyiségét
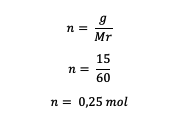
Ezután számítsa ki az oldat molalitását
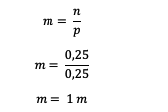
Tehát a karbamid oldat molalitása 1 m.
Nos, ez a molaritás és molalitás képlete a probléma definíciójával és példáival együtt. Könnyű nem? Remélhetőleg ez a cikk javítja a megértését, Igen. Szellem!
X ZÁRVA
Reklámok
HIRDETÉS
X ZÁRVA
