Valenciaelektronok: meghatározás, számítás, példaproblémák
Betöltés...
A vegyértékelektronok az atom legkülső szintjén lévő elektronok, amelyek részt vehetnek más atomokkal való kölcsönhatásban. A vegyértékérték egy atomot jelenthet, így a kölcsönhatási érték látható.
Az atomban lévő vegyértékek száma egy elem reaktív vagy inaktívvá válását okozhatja. Emiatt nagyon fontos a vegyértékek számának ismerete, hogy megismerjük egy kapcsolódó elem aktivitását.
Tartalomjegyzék
A vegyértékelektronok megértése
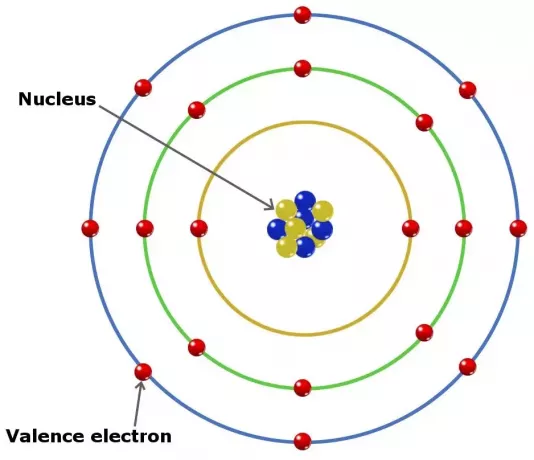
Az atomokban lévő vegyértékelektronok szerepet játszhatnak egy elemben kémiai kötés kialakításában. A főcsoport elemeiben a vegyértékelektronok a legkülső héj elektronjai.
Még így is, de nem minden ilyen típusú elektron van a külső héjban. Egyes átmeneti csoportba tartozó elemekben a vegyérték mélyebb, mint a külső héj.
Olvas: Elektron konfiguráció
Valence elektron táblázat
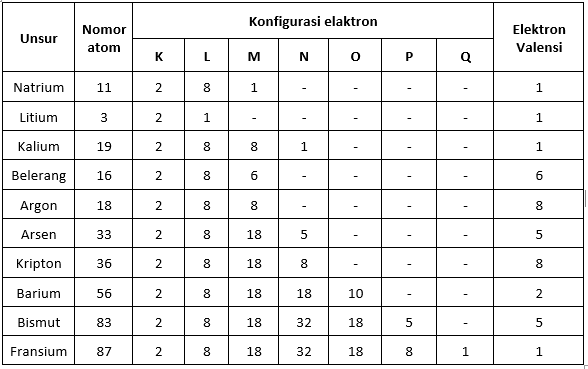
A vegyértékelektronok és az elemek periódusos rendszere
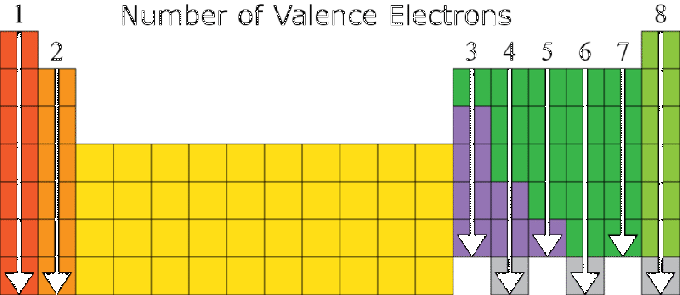
Egy elem tulajdonságai nagymértékben függnek az elektronkonfigurációjától, különösen a vegyértékszámától. Az azonos számú vegyértékkel rendelkező elemek általában hasonló tulajdonságokkal rendelkeznek. Emiatt az elemek periodikus rendszere a növekvő atomszám és az anyag tulajdonságainak hasonlósága alapján van elrendezve.
Összefüggés van egy elem atomjának elektronkonfigurációja és az elem periódusos rendszerben elfoglalt helyzete között, ahol:
- A csoportszám megegyezik a vegyértékértékek számával, kivéve a VIIIA csoport He elemét és az átmeneti csoportot.
- A periódusszám megegyezik az elektronon lévő héjak számával.
Elektromos vezetőképesség
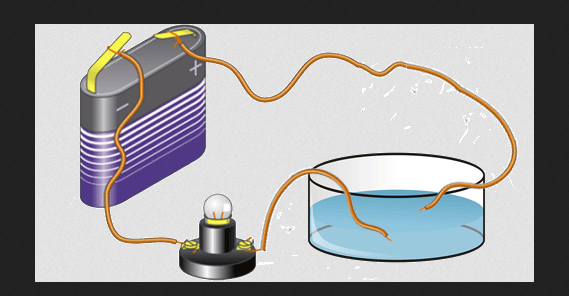
A vegyértékelektronok felelősek egy elem elektromos vezetőképességéért is. Ez teszi az elemeket nemfémek, félvezetők és fémek csoportjába. A fém elemek szilárd állapotban általában nagy elektromos vezetőképességgel rendelkeznek.
A periódusos rendszer minden sorában a fém a nemfémtől balra található. Tehát a fémeknek kevesebb vegyértékük van, mint a nemfémeknek.
A fématomok vegyértékértéke azonban kis ionizációs energiával rendelkezik, és szilárd állapotban ezek az elektronok viszonylag szabadon hagyhatnak el 1 atomot, vagy egyesülhetnek más atomokkal.
Az ilyen szabad elektronok elektromos tér hatására mozgathatók, mozgásuk elektromos áramot tartalmazhat. Ezek az elektronok felelősek a fémek elektromos vezetőképességéért. A jó vezető például az alumínium, a réz, az arany és az ezüst.
A nem fémes elemek elektromos vezetőképessége alacsony, ezért szigetelőként működnek. Az ehhez hasonló elemek a periódusos táblázatban láthatók jobbra, és vegyértékhéjuk legalább félig tele van.
Az ionizációs energiát nagynak mondják, ha az elektronok nem tudnak könnyen elhagyni az atomot elektromos térrel szemben. Tehát ez a fajta elem képes nagyon kis áramot vezetni.
A szigetelő elemek például a kén és a gyémánt. A fémeket tartalmazó szilárd vegyületek szigetelőnek is mondhatók, ha a fématomok vegyértékét használjuk fel ionos kötés kialakítására.
Olvas: Kvantummechanika
Elektron konfiguráció
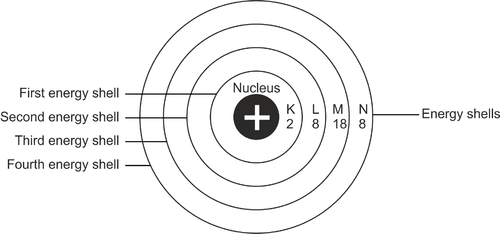
A konfigurációs folyamat az elektronok eloszlásának elrendezése egy atomban. Általában az elektronok egy bizonyos úton haladnak az atomban. Egy atom energiaszintje alapján határozzák meg. Ezek az utak elektronhéjak.
A bőrréteg első részét K betű jelöli. A bőrrétegek továbbra is L, M és így tovább ábécé sorrendben. A K-héj van a legközelebb az atommaghoz. A héj minden rétege csak bizonyos számú elektront tud befogadni.
Hirdetés
Tehát ha megtelik, az elektronok a következő rétegbe kerülnek. A bőr minden rétegét a maximális kapacitásig fel kell tölteni.
Hogyan számoljunk vegyértékelektronokat

Az elektronok helyzete, amikor elkezdik kitölteni az atomot, a héj első rétegétől kezdődik. Ez a bőrréteg van a legközelebb az atommaghoz, vagy K betűvel jelöljük. Az első réteg a legalacsonyabb energiaszinttel rendelkezik. Ha az első réteget 2 elektron tölti ki, akkor ez a következő L nevű réteg kitöltésével folytatódik.
Az L héj 8 elektron kapacitású. Ha megtelt, fokozatosan a következő bőrrétegre kerül. Az atom legkülső héjának teljes kapacitása 8 elektron.
A főcsoportba tartozó elemek, elektronkonfigurációjuk az elektronszám vagy az atomszám alapján határozható meg az alábbi szabályok szerint.
- Az elektronok teljesen feltöltődnek a bőrréteg által befogadható maximális határig.
- Ha még vannak elektronok, vagy nem tudják maximálisan kitölteni az elektronhéjréteget, akkor ügyeljen a következő rendelkezésekre.
- Ha a fennmaradó elektronok száma > 32, akkor a héj következő része 32 elektronnal van kitöltve
- Ha a fennmaradó elektronok száma < 32, a következő héjréteg 18 elektront fog befogadni;
- Ha a maradék elektronok száma < 18, akkor a következő réteg 8 elektronnal lesz kitöltve.
- Ha a fennmaradó szám 8, akkor a maradék elektronok kitölthetik a héj következő részét.
Olvas: Fizikai változás
Példák vegyértékelektron problémákra

Az anyag mélyebb megértése érdekében kérjük, nézzen meg néhány példát és a következő vitát.
1. példa
Határozza meg a következő elemek vegyértékét az elektronkonfigurációjuk alapján!
- 11Na
- 13Al
- 15P
- 18Ar
- 19K
Válasz:
- 11Na = 281
A Na vegyértékeinek száma = 1
- 13Al = 283
A vegyértékek száma Al = 3
- 15P = 285
Teljes vegyérték P = 5
- 18Ar = 288
A vegyértékek száma Ar = 8
- 19K = 2 8 8 1
A vegyértékek száma K = 1
2. példa
Hozzon létre egy elektronkonfigurációt, és határozza meg a következő elemek vegyértékértékeit a nemesgáz-elektron konfigurációk segítségével.
- 20kb
- 35br
- 36Kr
- 50Sn
- 86Rn
Válasz:
- 20Ca = [Ar] 4s2
A Ca vegyértékeinek összege = 2
- 35Br = [Ar] 3d10 4s2 4p5
Br vegyértékeinek összege = 7
- 36Kr = [Ar] 3d10 4s2 4p6
A vegyértékértékek összege Kr = 8
- 50Sn = [Kr] 4d10 5s2 5p2
Sn vegyértékeinek összege = 4
- 86Rn = [Xe] 4f14 5d10 6s2 6p6
A vegyértékértékek összege Rn = 8
3. példa
Kérjük, írja alá az elemek elektronjait, és határozza meg azok vegyértékét is!
- 10 Ne
- 33 MINKET
- 47 Ag
- 52 Te
- 54 Xe
Válasz:
- 10 Ne: 1s2 2s2 2p6
Ne vegyértékeinek összege = 8
- 33 Ász: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p3
As vegyértékeinek összege = 5
- 47 Ag: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d10
Ag vegyértékeinek összege = 1
- 52 Te: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p4
Te = 6 vegyértékértékeinek összege
- 54 Xe: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6
Xe vegyértékeinek összege = 8
A vegyértékelektronok a megadott út vagy pálya alapján határozhatók meg az elektronkonfiguráció segítségével. Annak ellenére, hogy meglehetősen bonyolultnak tűnik, ennek az anyagnak az elsajátítása olyasvalami, amit meg kell tenni ahhoz, hogy könnyen tudjon dolgozni a kérdéseken.
X ZÁRVA
Reklámok
HIRDETÉS
X ZÁRVA
