VEGYÜLETEK: meghatározás, típusok, példák
Betöltés...
Anélkül, hogy észrevennék, az emberek a mindennapi életben gyakran érintkeznek különféle típusú vegyületekkel. Bár talán nem mindenki ismeri fel, nemhogy megérti, mit jelent a vegyület. Valójában sok példa van a gyakran előforduló vegyületekre, például só, cukor, víz stb.
Általában a vegyületeket az alkotóelemek alapján több típusba sorolják. Míg a vegyületek bomlásának folyamata kémiai reakción keresztül megy végbe. Ezenkívül megkülönbözteti az egyes vegyülettípusok formáját, állagát, ízét és illatát.
Tartalomjegyzék
Összetett képletek elnevezése
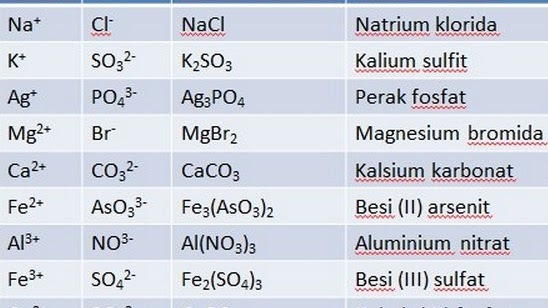
A vegyület egyetlen anyag, amely kémiai reakcióval két vagy több anyagra bontható. A mindennapi életben gyakran előforduló vegyület például a víz. A folyamat során a víz az oxigén (O) és a hidrogén (H) elemek kombinációja, amelynek kémiai képlete H20.
Az Indonéz Köztársaság Oktatási és Kulturális Minisztériumának hivatalos weboldala szerint az elem legkisebb része egy atom. Ha két atom kémiai reakció során egyesül, akkor molekulát vagy egy vegyület legkisebb részét képezi.
Eközben a vegyületek képzési folyamata kémiai keveréssel és termikus vagy elektromos bomlással. A vegyületek az alkotóelemeiktől eltérő tulajdonságokkal rendelkeznek.
Például a víz tulajdonságai eltérnek az azt alkotó elemek, nevezetesen az oxigén és a hidrogéngáz tulajdonságaitól. A külső megjelenésben is nagyon valós a különbség. Mivel a víz folyadék, a hidrogén gáz. Ezenkívül a víz felhasználható tüzek oltására.
A hidrogén azonban gyúlékony anyag. Míg az oxigén az égési folyamathoz szükséges anyag. Látható tehát, hogy az alkotóelemek és a keletkező vegyületek nagyon ellentétes tulajdonságokkal, formákkal és funkcióval rendelkeznek.
Tehát mi a különbség a vegyület és a keverék és az elem között? Bár a vegyületek és az elemek egyetlen anyagok. Vannak azonban különbségek a vegyületek és az elemek, valamint a keverékek között.
Ennek az az oka, hogy az elem egyetlen anyag, amely nem alakítható át egyszerűbb anyagokká, és az elem továbbra is megőrzi eredeti tulajdonságait vagy jellemzőit.
Példa az elemekre:
- Arany
- Vezet
- Vas
- Réz
- Cink
- Nikkel
A keverék olyan anyag, amely két vagy több anyagból áll, de még mindig az eredeti anyag tulajdonságaival rendelkezik. Példák a keverékekre:
- Levegő
- Folyóvíz
- Szikla
- Csokoládés tej
- Jód só
- Kávé
- Édes tea
Olvas: Folyékony
A vegyületek típusai
Mielőtt tovább tárgyalná a vegyületek abszolút példáit a mindennapi életben. Jó, ha meg tudod különböztetni a vegyületek fajtáit is.
Az alkotóelemek alapján a vegyületek több típusba sorolhatók, nevezetesen a következők szerint:
1. Szerves összetevő

Az élőlényekből és a fotoszintézis folyamatából származik. A szerves vegyületek fő láncként a szén (C) elemet tartalmazzák. Ennek a fajta szerves vegyületnek az a jellemző tulajdonsága, hogy vízben nem oldódik, és csak szerves oldószerekkel keverve oldódik.
Mivel a szén elemből (C) keletkezik, a szerves vegyületek gyúlékonyabbá válnak. Szerves vegyület például a cukor (C12H22011)
2. Szervetlen vegyület
Hirdetés

Ez a fajta vegyület ásványkincsekből származik. A szervetlen vegyületek forráspontja viszonylag magasabb, mint a szerves vegyületeké. A szervetlen vegyületek azonban általában nem gyúlékonyak és vízben könnyen oldódnak. Például szilícium-dioxid (SiO2).
3. Savanyú

Molekulák, amelyek képesek hidrogénionokat adni H+ és kovalens kötést képez Lewis savval. A kémiában a savas vegyületek három definícióból állnak: Arrhenius, Bronsted-Lowry és Lewis.
Általában a savak a következő tulajdonságokkal rendelkeznek:
- Vízben feloldva savanyú.
- Fémekkel keverve hevesen reagál.
- Érintésre csíp, és károsíthatja a bőrt.
- pH-értéke 7-nél kisebb.
- A savak elektrolitok, bár nem feltétlenül ionosak.
- A kék lakmuszpapírt pirosra tudja változtatni.
A savakat többféleképpen használják, beleértve a rozsda eltávolítását fémtárgyakról pácolás vagy pácolás útján. Ezenkívül a sav elektrolitként is használható nedves cellás akkumulátorokban. A kénsav katalizátorként használható benzin előállításához.
Olvas: Savbázis
4. Ionos vegyületek

Ez a kifejezés elektrosztatikusan összetartott ionokból álló kémiai vegyületet jelent (ionos kötések). Bár ez a vegyület összességében semleges, pozitív töltésű ionokból (kationok) és negatív töltésű ionokból (anionok) áll, mindkettő nátrium, klorid és karbonát formájában.
Az ionos vegyületek tulajdonságai:
- Nagyon magas forráspontja van, alacsony gőznyomás mellett.
- Lúgosság vagy hasonlóság savas vegyületekkel.
- A legtöbb ionos vegyület nagyon törékeny.
- Az ionos vegyületek összenyomhatóságát a szerkezet határozza meg.
- Könnyen oldódik poláris folyadékokban, például vízben. Azonban általában nehezen oldódik benzinben.
- Alacsony vezetőképességű és általában nem vezet jelentős elektromosságot.
Az ionos vegyületeknek sokféle felhasználása van, és az emberek általában használják a mindennapi életben. Az ionos vegyületek példái közé tartozik a magnézium-tej, a bórax és az oltott mész.
5. Só

A kémiában a sót ionos vegyületekre osztják, amelyek negatív ionokból (anionokból) és pozitív ionokból (kationok) állnak, így töltés nélküli vagy semleges vegyületeket képeznek. A só bázisok és savak, például klorid, acetát, fluor, szulfát nátrium-kloriddá való reakciójából keletkezik.
A létező sófajták közül mindegyik sónak más íze van, nevezetesen:
- Édes (ólom és acetát)
- Sós (nátrium-klorid)
- Sav (kálium-bitartarát)
- sós (mononátrium-glutamát)
- Keserű (magnézium-szulfát).
6. Oxid
Az oxidvegyületek oxigénatomokat és más elemeket tartalmaznak. Tudtad, hogy a földkéreg nagy része oxidokból áll? Ezek a vegyületek akkor keletkeznek, amikor az elemek oxigénnel oxidálódnak. Az oxidok általában magas forráspontú ionos szerkezetűek.
7. nyelv

A hidroniumionokat elnyelő vegyületek (H3O) vízben oldva. A bázis egy sav vagy kémiai elem kettőse, amelynek pH-ja 7-nél nagyobb. Általában az bázisokat két típusra osztják, nevezetesen a gyenge bázisokra és az erős bázisokra. Attól függ, hogy képes-e felszabadítani OH-ionokat.
Az alapoknak van néhány közös jellemzője, amelyek a következők:
- Keserű ízű.
- Sima alap textúra, mint a szappan.
- A vörös lakmusz színét kékre tudja változtatni.
- Képes elektromos áramot vezetni.
- Semlegesítheti a savakat.
- Időjárást okoz.
- A pH-érték meghaladja a 7-et.
Olvas: Szilárd
Példák vegyületekre a mindennapi életben

A mindennapi életben az élőlényeket nem lehet elválasztani a vegyületektől. Sőt, nagyon sok olyan vegyület van, amelyet az emberek a túléléshez fogyasztanak.
Az alábbiakban példák az emberek által gyakran használt vegyületekre:
| Összetett példa | Kémiai formula |
| Szén-monoxid gáz | CO |
| Szén-dioxid gáz | CO2 |
| Nitrogén-monoxid gáz | NEM |
| Víz | H2O |
| Konyhai só | Nátrium-klorid / NaCl |
| Sósav | HCI |
| Kénsav | H2ÍGY4 |
| Ecetsav (ecet) | CH3COOH |
| Ammónia gáz | NH3 |
| Nátrium-hidroxid | NaOH |
| Cukor | C12H22011 |
| Karbamid | CO(NH2)2 |
| Alkohol | C2H3OH |
| Kalcium | CaCo3 |
Példák ismeretében a vegyületekre és típusaikra. Most már jobban megértheti, hogy milyen vegyületeket tartalmaznak az ételek, italok és a mindennapi használati tárgyak. Így körültekintőbb lehet a fogyasztás és a felhasználás kiválasztásakor is.
X ZÁRVA
Reklámok
HIRDETÉS
X ZÁRVA
