Példa molalitási problémára: móltört, képlet és megoldás
Példa molalitási probléma: móltört, képlet és megoldás – Ez alkalommal A know.co.id a molalitást számos kérdéspéldával tárgyalja majd, és természetesen más dolgokról is, amelyek szintén ezt fedik. Nézzük meg együtt a vitát az alábbi cikkben, hogy jobban megértsük.
Példa molalitási problémára: móltört, képlet és megoldás
A molalitás vagy mólkoncentráció az oldatban lévő oldott anyag koncentrációjának mértéke az oldószer bizonyos tömegében lévő anyag mennyiségében. Ez eltér a molaritás meghatározásától, amely az oldat bizonyos térfogatán alapul.
A molalitás közös mértékegysége a kémiában mol/kg. Az 1 mol/kg koncentrációjú oldatot néha 1 mol-ban is kifejezik. A molalitás kifejezést a molaritás analógiájára hozzuk létre, amely az oldat moláris koncentrációja.
Az oldat molalitását némi oldószer hozzáadásával lehet vizsgálni. Egyszerűbben, az oldat molalitása (m) az oldott anyag móljai osztva az oldószer kilogrammjával. A molalitás vagy molalitás az oldat koncentrációja, amely megadja az oldott anyag mólszámát (n) 1 kg vagy 1000 gramm oldószerben.
A molalitás és a molaritás közötti különbség az, hogy ha a molalitás molalitás, vagy a molalitás (m) a mólok számát fejezi ki oldott anyag 1000 gramm oldószerben, míg a molaritás az egy literben lévő oldott anyag móljainak száma. megoldás. A molaritást az M jelöléssel jelöljük, és a mértékegységek mol/liter.
Molality Formula
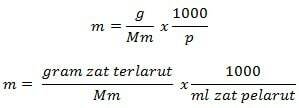
Információ
m = molalitás (mol/kg)
g = oldott anyag grammja (g)
Mm = az anyag moláris tömege (g/mol)
P = az oldószer tömege (g)
Molalitás kapcsolat a tömegszázalékkal
A tömegszázalék a kémiai oldatokban általánosan használt koncentrációegység. A mindennapos megoldásokra példa a 75%-os alkoholos oldat és a 24%-os ecetsavoldat. A tömegszázalék az oldott anyag grammjainak száma 100 gramm oldattömegben. A tömegszázalék kiszámítását mutató egyenlet a következő:

Kapcsolat Molalitás Molaritással
A molaritás azt fejezi ki, hogy egy liter oldatban hány mólnyi oldott anyag van. A molaritás az oldat térfogatát az oldat tömegére konvertálva alakítható át molalitássá. A térfogat tömegre konvertálásához adatokra van szükség az oldat sűrűségére vonatkozóan (p), amelyet a következőképpen lehet megfogalmazni:

Mol Frakció
A móltört az oldat koncentrációjának mértéke, amely az anyag egy részében lévő mólszám és az oldat komponenseiben jelenlévő összes mólszám arányát fejezi ki. A mólfrakció 2 részre oszlik:
Oldott móltört (Xt)
Az oldott anyag móltörtjének képlete (Xt), nevezetesen:

Információ:
Xt = az oldott anyag mólhányada
Nt = az oldott anyag móljainak száma
Np = az oldószer móljainak száma
Oldószer móltört (Xp)
Az oldószer mólfrakciójának képlete (Xp), nevezetesen:

Információ
Xp = az oldószer mólhányada
Nt = az oldott anyag móljainak száma
Np = az oldószer móljainak száma
Az oldott anyag és az oldószer móltörteinek összege 1
Xt + Xp = 1
Példák molalitási problémákra és megoldásokra
1. probléma
Mekkora a molalitása annak az oldatnak, amely 4 g NaOH-t (Ar Na = 23 g/mol, Ar O = 16 g/mol és Ar H = 1 g/mol) tartalmaz 250 g vízben oldva?
Befejezés:
Ismert:
NaOH tömege = 4 gr
ArNa = 23 g/mol
ArO = 16 g/mol
ArH = 1 gr/mol
víztömeg = 250 gr = 0,25 kg
Kérdezte: m = ?
Válasz:
Úr. NaOH = 40 g/mol
a NaOH móljainak száma = tömeg/Mr
a NaOH móljainak száma = 4 gr/(40 gr/mol)
a NaOH móljainak száma = 0,1 mol
m = mólszám/p
m = 0,1 mol/0,25 kg
m = 0,4 m
2. probléma
Mekkora a 37%-os (w/w) HCl-oldat molalitása? (Ar H = 1 g/mol, Ar Cl = 35,5 g/mol)
Befejezés:
Ismert:
HCl tömege = 37%
ArH = 1 g/mol
ArCl = 35,5 g/mol
Kérdezte: m = ?
Válasz:
Úr. HCl = 36,5 g/mol
Tegyük fel, hogy az oldat tömege 100 gramm, akkor a HCl tömege:
HCl tömeg = 37% x 100 gr
HCl tömege = 37 gr
oldószer tömege = oldat tömege – HCl tömege
oldószer tömege = 100 gr – 37 gr
oldószer tömege = 63 gr = 0,063 kg
HCl móljainak száma = tömeg/Mr
HCl mólszáma = 37 gr /(36,5 g/mol)
a HCl móljainak száma = 1,01 mol
m = mólszám/oldószer tömeg
m = 1,01 mol/0,063 kg
m = 16,03 m
3. probléma
Határozzuk meg a 12 gramm karbamid CO(NH2)2 250 gramm vízben való feloldásával készített oldat molalitását.
Befejezés:
Ismert:
karbamid tömege = 12 gr
Mr. karbamid = 60 g/mol
oldószer tömege = 250 gr = 0,25 kg
Kérdezte: m = ?
Hirdetés
Válasz:
a karbamid móljainak száma = tömeg/Mr
a karbamid móljainak száma = 12 g /(60 g/mol)
a karbamid móljainak száma = 0,2 mol
m = mólszám/oldószer tömeg
m = 0,2 mol/0,25 kg
m = 0,8 m
4. probléma
Mekkora a 23 tömeg% etanolt (Mr = 46) tartalmazó alkoholos oldat molalitása?
Válasz:
Ismert:
etanol tömege = 23%
Mr etanol = 46 g/mol
Kérdezte: m = ?
Befejezés:
például az alkoholos oldat tömege 100 gramm, akkor az etanol tömege:
etanol tömege = 23% x 100 gr
etanol tömege = 23 gr
oldószer tömege = oldat tömege – etanol tömege
oldószer tömege = 100 gr – 23 gr
oldószer tömege = 77 gr = 0,077 kg
etanol móljainak száma = tömeg/Mr
etanol móljainak száma = 23 g /(46 g/mol)
az etanol móljainak száma = 0,5 mol
m = mólszám/oldószer tömeg
m = 0,5 mol/0,077 kg
m = 6,49 m
5. probléma
Számítsa ki a glükóz koncentrációját (tömegszázalékban) egy 2 molos glükózoldatban.
Befejezés:
Ismert:
m = 2 mol = 2 mol/kg = 0,002 mol/gr
Mr glükóz = 180 gr/mol
Kérdezte: glükóz tömege (%) = ?
Válasz:
mol glükóz = tömeg/Mr
mol glükóz = glükóz tömege/(180 g/mol)
mol glükóz = glükóz tömege x 0,005 mol/gr
Helyettesítsd be a glükóz móljait a következő egyenletbe:
m = glükóz mol/oldószer tömege
0,002 = glükóz tömege x 0,005/oldószer tömege
o, oo2/o, oo5 = glükóz tömege/oldószer tömege
2/5 = glükóz tömege/oldószer tömege
Tehát a glükóz: oldószer tömegaránya = 2:5, míg a glükóz: az oldat tömegaránya = 2:7.
Így,
glükóz tömegszázalék = (glükóz tömege/oldat tömege) x100%
glükóz tömegszázaléka = (2/7) x 100%
% glükóz tömeg = 28,57 %
6. probléma
Mekkora a molalitása annak az oldatnak, amely 8 g NaOH-t (Ar Na = 23 g/mol, Ar O = 16 g/mol és Ar H = 1 g/mol) tartalmaz 250 g vízben oldva?
Vita
Ismert:
NaOH tömege = 8 gr
ArNa = 23 g/mol
ArO = 16 g/mol
ArH = 1 gr/mol
víztömeg = 250 gr = 0,25 kg
Keresett: Molality (m)….?
Válasz:
Úr. NaOH = 40 g/mol
A NaOH móljainak száma = tömeg/Mr
A NaOH móljainak száma = 8 gr/(40 gr/mol)
A NaOH móljainak száma = 0,2 mol
m = mólszám/p
m = 0,2 mol/0,25 kg
m = 0,8 m
6. probléma
Határozzuk meg a 15 gramm karbamid CO(NH2)2 250 gramm vízben való feloldásával készített oldat molalitását.
Vita
Ismert:
A karbamid tömege = 15 gr
Mr. karbamid = 60 g/mol
Oldószer tömeg = 250 gr = 0,25 kg
Keresett: Molality (m)…. ?
Válasz:
A karbamid móljainak száma = tömeg/Mr
Összes mol karbamid = 15 gr / 60 g/mol
A karbamid móljainak száma = 0,25 mol
m = mólszám/oldószer tömeg
m = 0,25 mol/0,25 kg
m = 1 m
7. probléma
Mekkora a 37%-os (w/w) HCl-oldat molalitása? (Ar H = 1 g/mol, Ar Cl = 35,5 g/mol).
Vita
Ismert:
HCl tömege = 37%
ArH = 1 g/mol
ArCl = 35,5 g/mol
Keresett: Molality (m)…?
Válasz:
Úr. HCl = 36,5 g/mol
Tegyük fel, hogy az oldat tömege 100 gramm, akkor a HCl tömege:
HCl tömeg = 37% x 100 gr
HCl tömege = 37 gr
oldószer tömege = oldat tömege – HCl tömege
oldószer tömege = 100 gr – 37 gr
oldószer tömege = 63 gr = 0,063 kg
HCl móljainak száma = tömeg/Mr
HCl mólszáma = 37 gr /(36,5 g/mol)
a HCl móljainak száma = 1,01 mol
m = mólszám/oldószer tömeg
m = 1,01 mol/0,063 kg
m = 16,03 m

8. probléma
Határozza meg a NaOH mennyiségét (grammban), amelyet fel kell oldani 1 liter vízben (víz = 1,00 g/ml), hogy 0,25 m NaOH-t kapjunk.
Vita
Ismert:
1 liter víz = 1000 ml = 1000 g (mivel ρ víz = 1,00 g/ml)
mNaOH = 0,25 m
Mr NaOh = 40
Kérdezte: gr…?
Válasz:
mNaOH = gr / Mr x 1000 / P
0,25 = gr/40 x 1000/1000
0,25 = g/40
g = 0,25 x 40
g = 10 gramm
Tehát a szükséges NaOH mennyisége 10 gramm.
9. probléma
Határozza meg, hány ml víz szükséges 4,9 gramm H2SO4 feloldásához, amelynek koncentrációja 0,25 M (Ar H = 1; S=32; O =16)!
Vita
Ismert:
mH2S04 = 0,25
Mr H2SO4 = 98
gr = 4,9 gramm
Kérdezte :p???
Válasz:
m = gr/Mr x 1000/P
0,25 = 4,9/98 x 1000/p
p = 20 gramm (20 ml)
Tehát a víz térfogata 20 ml.
10. probléma
Mekkora víztömeg szükséges egy 1,2 m-es oldat elkészítéséhez 0,6 mol NaCl felhasználásával?
Vita
molalitás (m) = 1,2 mm =
nP
1,2 =
0,6P
P=
0,61,2
= 0,5 kg
Tehát a szükséges víz tömeg (oldószer tömege) 0,5 kg
11. probléma
Tegyük fel, hogy 1 liter oldószerben 2 mol oldott anyag van feloldva, mekkora a molalitás?
Vita
oldott mol (n) = 2 mol =
nP
m =
21
= 2 m
Számítsuk ki 25 gramm KBr (Mr = 119) molalitását 750 ml tiszta vízben.
Vita
oldott anyag = 25 gramm
Mr = 119
oldószer (P) = 750 ml = 750 gramm (mert ρ víz = 1,00 g/ml) = 0,75 kgn =
oldott anyagúr
n =
25119
= 0,21 mol
m =
nP
m =
0,210,75
= 0,28 m
Így a felülvizsgálat a A know.co.id ról ről Példa a molalitási problémára , remélhetőleg gyarapíthatja belátását és tudását. Köszönjük látogatását, és ne felejtsen el elolvasni más cikkeket sem.
Tartalomjegyzék
Ajánlást:
- A cellulóz: meghatározás, típus, szerkezet, tulajdonságok és… A cellulóz: meghatározása, típusa, szerkezete, tulajdonságai és funkciói – A cellulóz rostszerű vegyület, és a növények védősejtfalában található. Hogy jobban megértsük, természetesen megbeszéljük…
- √ A kiterjedés meghatározása az anyag hosszában, képletében, területében és térfogatában… A hosszú tágulás definíciója, képletek, szilárdtestek területe és térfogata - Ebben a beszélgetésben a hosszú tágulásról fogunk beszélni. Ami magában foglalja a hosszú tágulás fogalmát, a hosszú tágulási képleteket, a területet, az anyag térfogatát...
- Intézkedések: meghatározás, hosszegység átalakítás, hogyan… Mérőlétra: definíció, hosszmértékegységek átváltása, használat és példakérdések – mi van mit értesz méretlétrán, és hogyan kell használni?, ezúttal a Knowledge.co.id lesz vitassuk meg...
- Kovalens kötések: meghatározás, jellemzők, típusok, képletek… Kovalens kötések: A vegyületek meghatározása, jellemzői, típusai, kémiai képletei és tulajdonságai - Mi a kovalens kötés? Ebből az alkalomból a Seputarknowledge.co.id megvitatja ezt és persze más dolgokról is eltakarta. Legyen…
- Környezeti beszéd: meghatározás, cél, jellemzők és… Környezeti beszéd: meghatározás, cél, jellemzők és példák – Hogyan épül fel a környezeti beszéd szövege? mi a jó és mi a helyes?, Ebből az alkalomból a Seputarknowledge.co.id megvitatja ezt és persze a dolgokat Melyik…
- Kúpképletek, jellemzők, tulajdonságok, elemek és problémák példái Kúpképletek, jellemzők, tulajdonságok, elemek és példák Probléma – Hogyan számítsuk ki egy alakzat területét és térfogatát kúptér?, Ebből az alkalomból a Seputarknowledge.co.id megvitatja ezt és természetesen más dolgokról is Melyik…
- Viszkozitási képlet: A viszkozitás, együttható és… Viszkozitási képlet: viszkozitás meghatározása, együttható és befolyásoló tényezők – Hogyan működik a viszkozitási képlet A viszkozitás egy olyan folyadék ellenállásának mérése, amely feszültség vagy feszültség hatására megváltozik nyomás. Ebből az alkalomból a Seputarknowledge.co.id…
- Súlyegység: meghatározás, konverziós létra és példák… Súlyegység: definíció, konverziós létra és példaprobléma – Mi a súlyegység?, ebből az alkalomból A Knowledge.co.id megvitatja, beleértve a megértést és természetesen más dolgokat is eltakarta. Legyen…
- Tehetetlenségi momentum: definíció, tényezők, formaegyenletek… Tehetetlenségi momentum: definíció, tényezők, egyenletek objektumok formáiban és példaproblémák – mit jelent a Tehetetlenség Pillanatával?, Ebből az alkalomból Se a know.co.id-dal kapcsolatban megvitatja, és természetesen kb. ügy…
- Egyenletesen változó körkörös mozgás: meghatározás, nagyság… Egyenletesen változó körmozgás: meghatározás, fizikai mennyiség, képletek és példák a problémákra – Mi a mozgás Rendszeres körkörös változások és példák? Ebből az alkalomból a Seputarknowledge.co.id megvitatja, és persze kb...
- Határozatlan integrál: definíció, képletek, tulajdonságok és példák… Határozatlan integrál: definíció, képletek, tulajdonságok és példák a problémákra – mit jelent a határozatlan integrál? Természetesen és hogyan kell kiszámítani a matematikai műveleteket? akarat…
- A tanulási módszerek meghatározása: jellemzők, cél, típusok és… A tanulási módszerek meghatározása: jellemzők, célja, típusai és megvitatása – Mit értünk módszer alatt Learning? Is…
- Kémiai egyensúly: definíció, törvények, képletek, példafeladatok Kémiai egyensúly: definíció, törvények, képletek, példaproblémák – ebben a beszélgetésben elmagyarázzuk a kémiai egyensúlyról, a képlettörvényről és példákkal ellátva a kémiai egyensúly teljes és...
- Sav-bázis oldatok: meghatározás, sav-bázis elmélet, tulajdonságok és… Sav-bázis oldatok: meghatározás, sav-bázis elmélet, tulajdonságai és típusai - A sav- és bázisoldatok a kémiai vegyületek két csoportja, amelyek széles körben megtalálhatók és használatosak a mindennapi életben.
- Építs teret – meghatározás, képletek és különféle… Térépítés – Definíció, képletek és különféle típusai – Ebből az alkalomból szeretnénk áttekinteni a geometriai alakzatokkal kapcsolatos matematikai anyagokat, mind megértésből, mind másokból. Azonnal beszéljük meg...
- √ Sav-bázis indikátor: meghatározás, típusok és példák Sav-bázis indikátorok: definíciók, típusok és példák – Ebből az alkalomból az Around Knowledge a sav-bázis indikátorokról lesz szó. Ami ebben a vitában megmagyarázza a savjelző jelentését...
- Boyle törvénye: definíciók, képletek, alkalmazások és példák… Boyle-törvény: Definíciók, képletek, alkalmazások és példák a problémákra – Ebben a beszélgetésben a Boyle-törvényről fogunk beszélni. Amely magában foglalja a Boyle-törvény jelentését, a Boyle-törvény képletét, az alkalmazását…
- Motivációs novellák: meghatározás, írási tippek és példák Motivációs novellák: meghatározás, írási tippek és példák – Mi az a motivációs novella? Ebből az alkalomból a Seputarknowledge.co.id megvitatja, hogy ez a Barátság rövid története és egyéb dolgok erről. Lássuk…
- A nyomás meghatározása: nyomásfajták, képletek és példaproblémák A nyomás definíciója: a nyomás típusai, képletek és példaproblémák - Mi a nyomás? Ebből az alkalomból a know.co.id környékén megvitatjuk, mi a nyomás, és milyen egyéb elemek eltakarta. Lássuk…
- Dinamikus folyadékok: típusok, jellemzők, Bernoulli-egyenlet, tételek… Dinamikus folyadékok: típusok, tulajdonságok, Bernoulli-egyenlet, Toricelli-tétel, képletek és példák a problémákra - mi ez dinamikus folyadékok és típusaik? ról ről…
- A víz sűrűsége: meghatározás, képletek és példák A víz sűrűsége: meghatározás, képletek és példák - Mi a víz sűrűsége? Lássuk együtt…
- A mennyiség meghatározása, mértékegysége, mértéke és példák… Mennyiség, mértékegység, mérés és példák meghatározása (teljes) - A fizika alapfogalmaiban biztosan megismerkedtünk valamivel, ami a mindennapi élettel kapcsolatos. Például a magasság mérése, a tömeg mérése, a szélesség mérése,...
- Példák tudományos munkára: A nyelv funkciói és szabályai Példák tudományos közleményekre: A nyelv funkciói és szabályai – Milyen példák vannak a tudományos közlemények írásának jó és helyes formáira? Korábban a Seputar, a know.co.id megvitatta a Tudományos munkát: meghatározás, jellemzők, előnyök,…
- Példák lapos alakzatokra: A lapos alakzatok típusai, jellemzői és képletei Példák lapos alakzatokra: lapos alakzatok típusai, tulajdonságai és képlete – Melyek a lapos alakzatok példái?
- Testnevelési kérdések minta a 11. osztályhoz (XI.) SMA/MA/SMK 1. és 2. félév Példák testnevelési kérdésekre a 11. (XI) osztályban az SMA/MA/SMK 1. és 2. szemeszterhez (2019 és 2020) – Ebből az alkalomból a Seputarknowledge.co.id a 11. osztály testnevelési kérdéseinek példáit tárgyalja feleletválasztós és esszé …
- A csapadék mennyisége: 12 meghatározás szakértők, típusok,… A csapadék: 12 definíció a szakértők típusai és faktorai szerint – Ebben a beszélgetésben az Around Knowledge a csapadékról fog magyarázatot adni. A csapadék olyan éghajlati esemény, amely természetes,...
- √ A kémiai vegyületek meghatározása, jellemzői, típusai és nómenklatúrája… A kémiai vegyületek meghatározása, jellemzői, típusai, teljes nómenklatúra – Ebben a vitában a kémiai vegyületekről fogunk beszélni. Tartalmazza a kémiai vegyületek meghatározását, jellemzőit, típusait és nómenklatúráját, megvitatva...
- Az egyes anyagok a következők: meghatározás, elemek és vegyületek Az egyedi anyagok: meghatározások, elemek és vegyületek – Mit jelent egyetlen anyag? Nézzük együtt a vitát...
- Ferde sík: meghatározás, képletek, mechanikai előnyök és… Ferde sík: meghatározás, képletek, mechanikai előnyök és példák a problémákra - Mit értünk síkon ferde és hogyan kell kiszámítani a fizikát? természetesen…
- Mértékegység átváltása: Meghatározás, Tényező, Hosszúság, Tömeg, Idő,… Mértékegység átváltás: definíció, tényező, hossz, tömeg, idő, térfogat és nyomás – mi az egységváltás?, Ebből az alkalomból a Seputarknowledge.co.id megvitatja, beleértve a tényezőket, típusokat és természetesen más dolgokat is. Melyik…
