Oksidacijski brojevi: definicija, pravila određivanja i primjeri problema
Oksidacijski brojevi: definicija, pravila određivanja i primjeri problema - Što je oksidacijski broj i primjer? Ovom prilikom O Knowledge.co.id raspravit će o tome i naravno o drugim stvarima koje ga također okružuju.
Pogledajmo raspravu u donjem članku kako bismo je bolje razumjeli
Sadržaj
-
Oksidacijski brojevi: definicija, pravila određivanja i primjeri problema
- Pravila za određivanje oksidacije
- Primjeri oksidacijskih brojeva
- Podijeli ovo:
- Vezane objave:
Oksidacijski brojevi: definicija, pravila određivanja i primjeri problema
Oksidacijski broj ili oksidacijsko stanje je broj negativnih i pozitivnih naboja u atomu, što neizravno ukazuje na broj elektrona koji su prihvaćeni ili su predani drugim atomima. Neki atomi imaju samo jedno oksidacijsko stanje, ali neki atomi imaju više oksidacijskih stanja.
Ako u molekuli ili spoju pronađete vrijednost atomskog broja, prvo morate znati oksidacijsko stanje atoma ostalih elemenata koji imaju opća (standardna) svojstva.
Pravila za određivanje oksidacije
Da biste odredili oksidacijski broj (Biloks) u ionu ili drugim spojevima, morate slijediti donja pravila:
-
Oksidacijski broj slobodnih elemenata u obliku atoma ili molekula elemenata je 0 (nula).
Slobodni elementi u obliku atoma su:
- Stanje oksidacije C na C je = 0
- Stanje oksidacije Ca u Ca je = 0
- Stanje oksidacije Cu na Cu je = 0
- Stanje oksidacije Na u Na je = 0
- Stanje oksidacije Fe u Fe je = 0
- Oksidacijski broj Al u Al je = 0
- Stanje oksidacije Ne u Ne jednako je 0
Slobodni elementi u obliku molekula su:
- H oksidacijsko stanje H2 je = 0
- Stanje oksidacije O u O2 je = 0
- Stanje oksidacije Cl u Cl2 je = 0
- Stanje oksidacije P u P4 je = 0
- Stanje oksidacije S u S8 je = 0
-
Stanje oksidacije metala u spoju je uvijek pozitivno.
U skupini 1 metalni elementi (stari sustav Gol. IA) (Li, Na, K, Rb, Cs, Fr), njegovo oksidacijsko stanje je +1.
- Stanje oksidacije K u KCl, KNO3 ili K2SO4 je = +1
U skupini 2 metalni elementi (stara skupina sustava. IIA) (Be, Mg, Ca, Sr, Ba, Ra), njegovo oksidacijsko stanje je +2.
- Stanje oksidacije Mg u MgO, MgCl2 ili MgSO4 je = +2
Oksidacijski brojevi (Biloks) ostalih metalnih elemenata su:
- Ag vrijedi = +1
- Cu vrijedi = +1 i +2
- Hg vrijedi = +1 i +2
- Au vrijedi = +1 i +3
- Fe vrijedi = +2 i +3
-
Oksidacijski broj (Bilox) monoatomskih (za 1 atom) i polikatnih iona (za više od 1 atoma) jednak je u naboju iona.
-
Stanja oksidacije monatomskih iona su Na +, Ca2 +, Al3 +, Cl–, odnosno 02- + 1, + 2, +3, -1 i -2.
- Stanja oksidacije polikatnih iona su NH4 +, SO42-, PO43-, odnosno +1, -2 i -3.
-
-
Oksidacijski broj elemenata skupine VIA (O, S, Se, Te, Po) u binarnim spojevima je -2, a elemenata skupine VIIA (F, Cl, Br, I, At) u binarnim spojevima -1.
-
Stanje oksidacije elementa S u Na2S i MgS je = -2.
- Stanje oksidacije elementa Cl u NaCl, KCl, MgCl2 i FeCl3 je = -1.
-
-
Oksidacijski broj elementa H u njegovim spojevima je = +1.
Osim stupnja oksidacije hidrida (vodikovi spojevi s metalima) vrijednost = -1.
Budući da u hidridima vodik postoji u obliku hidridnog iona, H–. Stanje oksidacije iona poput hidrida isto je kao i naboj na ionu, koji je = -1.
- Stanje oksidacije elementa H u H2O, HCl, H2S i NH3 je = +1.
- Stanje oksidacije elementa H u NaH, CaH2 i AlH3 je = -1.
-
Oksidacijski broj elementa O u njegovom spoju je -2, osim,
-
Oksidacijski broj binarnog spoja u F je = +2.
- Stanje oksidacije spojeva peroksida, poput H2O2, Na2O2 i BaO2, je = -1.
- Stanje oksidacije superoksidnih spojeva, poput KO2 i NaO2, je = -½.
- Oksidacijski broj (Biloks) elementa O u H2O, KOH, H2SO4 i Na3PO4 je = -2
-
-
Zbroj oksidacijskih brojeva elemenata u spoju je 0 (nula).
Zbroj oksidacijskog broja elemenata koji tvore ione ili višeatomske spojeve jednak je naboju na samom poligatnom ionu.
-
Oksidacijski broj kisika (O) u peroksidnom spoju = -1. Oksidacijski broj O u neperoksidnim spojevima = -2.
Primjer:
O oksidacijsko stanje u BaO2 = -1.
Atom Ba je metalni element skupine IIA, pa je oksidacijsko stanje Ba = +2. Zbroj oksidacijskih stanja Ba i O mora biti 0 (točka 6 pravila oksidacije). Stoga oksidacijsko stanje O mora biti -2. Budući da atom O ima indeks 2, tako je i stanje oksidacije O: indeks O = -2: 2 = -1. Dokazano je da je oksidacijsko stanje O u BaO2 je -1.
Primjeri oksidacijskih brojeva
Primjer Pitanje 1
Odredite oksidacijske brojeve elemenata podebljano u sljedećim spojevima:
- N2O5
- MnO4–
- Al2(TAKO4)3
Odgovor:
Odredit će se stanje oksidacije, na primjer x:
- 1. Napuni N2O5 tj. (2 x oksidacijsko stanje N) + (5 x oksidacijsko stanje O)
0 = (2x (x)) + (5 x (-2))
0 = 2x - 10
x = +5
Dakle, oksidacijski broj N-atoma u spoju N2O5 je +5
- 2. Naboj MnO4– je (1 x oksidacijski broj Mn) + (4 x oksidacijsko stanje O) kako slijedi!
-1 je (1 x (x)) + (4 x (-2))
-1 je x - 8
x je +7
Dakle, oksidacijski broj atoma Mn u spoju MnO je4– odnosno +7
- 3. Al opterećenje2(TAKO4)3 = (2 x oksidacijsko stanje Al) + (3 x oksidacijsko stanje S) + (12 x oksidacijsko stanje O), je:
0 = (2 x (+3)) + (3 x (x)) + (12 x (-2))
0 = 6 + 3x -24
x = +6
Dakle, oksidacijski broj atoma S u spoju Al je2(TAKO4)3 to je +6.
Primjer pitanje 2
Odmah za primjer problema u oksidacijskim brojevima, onaj u 'Koji je oksidacijski broj atoma C u oksidacijskom broju u CH4 s pravilom oksidacijskog broja H = +1?
Odgovor:
Oxx od H x Broj atoma H = + '1 x 4 = +4
Oxx C x Broj atoma C = a x 1 = a
Ako se iz spoja promatra neutralni spoj, tada broj oksidacijskih elemenata u njemu mora biti nula, što znači:
a + (+4) = O
a = -4
Dakle, oksidacijski broj C u spoju CH4 je -4.
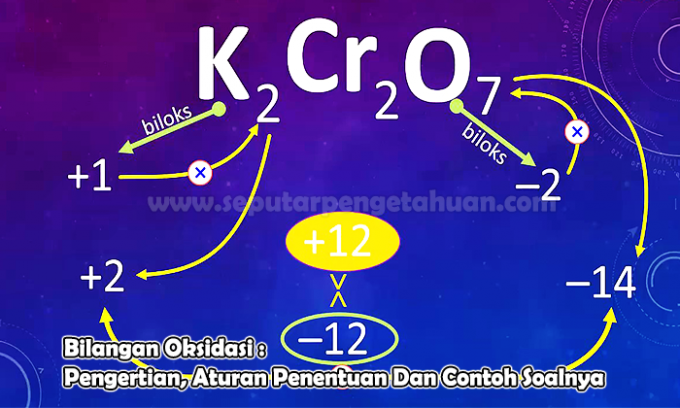
Primjer 3. pitanje
Odredite oksidacijski broj elementa N u sljedećim spojevima:
N2O5
Odgovor:
Stanje oksidacije označit će se s X
Napuni N2O5 tj. (2 x oksidacijsko stanje N) + (5 x oksidacijsko stanje O)
0 = (2 x (x)) + (5 x (-2))
0 = 2x - 10
x = +5
Dakle, oksidacijski broj N-atoma u spoju N je2O5 to je +5.
To je pregled od O Knowledge.co.id oko Oksidacijski brojevi: definicija, pravila određivanja i primjeri problema, Nadam se da će vam dodati uvid i znanje. Zahvaljujemo na posjeti i ne zaboravite pročitati druge članke.
Također pročitajte:BMKG: Definicija, povijest, položaj i aktivnosti
