Matériau de réaction redox: concepts, égalisations, exemples
Chargement...
Exemples de réactions redox que nous entendons souvent lorsque nous étions au lycée. Une réaction redox est une réaction chimique qui se produit en raison d'une combinaison de réactions de réduction et d'oxydation. C'est pourquoi le terme devient redox (réduction-oxydation)
Cette réaction comprend tous les processus chimiques allant des atomes aux changements d'état du nombre d'oxydation ou de l'état d'oxydation. Dans une réaction chimique complète, cette réaction d'oxydation est toujours suivie d'une réaction de réduction, on parle alors de réaction redox.
Table des matières
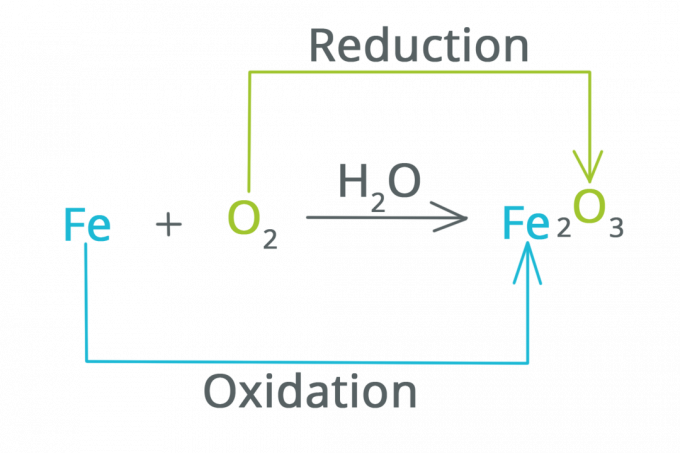
Réduction et oxydation

Comme mentionné précédemment, les réactions redox sont une abréviation de réactions de réduction et d'oxydation qui se produisent lorsqu'un processus électrochimique se produit.
La réduction est une réaction dans laquelle le nombre d'oxydation diminue et les électrons augmentent. On peut dire que la réduction est une réaction qui fait qu'une substance perd de l'oxygène.
L'oxydation est une réaction dans laquelle le nombre d'oxydation augmente et les électrons diminuent. On peut dire que l'oxydation est une réaction dans laquelle une substance se lie à l'oxygène.
Lis: Liquide
Indice d'oxydation (Oilox)

Le concept d'une réaction redox impliquant le transfert d'électrons ne peut se produire que dans les composés ioniques, alors que ce n'est pas le cas pour les composés covalents. Par conséquent, un troisième concept redox a émergé, à savoir basé sur les changements des nombres d'oxydation.
Le nombre d'oxydation est la charge positive et négative sur un atome. Les éléments avec des états d'oxydation positifs sont généralement des atomes avec des éléments métalliques, tandis que pour les éléments avec des états d'oxydation négatifs, des atomes non métalliques sont généralement utilisés.
Sur la base du concept de modification du nombre d'oxydation, il existe huit règles pour déterminer ce nombre, à savoir:
- Le nombre d'oxydation des éléments libres de forme atomique et moléculaire est 0
- Le nombre d'oxydation des ions monoatomiques et polyatomiques selon le type de charge sur l'ion
- Le nombre d'oxydation des éléments des groupes IA, IIA, IIIA selon le groupe auquel ils appartiennent
- Le nombre d'oxydation des éléments du groupe de transition est supérieur à un
- La somme des nombres d'oxydation des éléments qui composent un ion = la quantité de charge qu'il a
- Le nombre d'oxydation de l'hydrogène lorsqu'il est lié à un métal = -1, alors que si H est lié à un non-métal, il est +1
- Nombre d'oxygène dans les composés peroxydes = -1, nombre d'oxydation de O dans les composés non peroxydes = -2
Réduction et oxydation

Avant de discuter d'exemples de réactions redox, il n'est jamais inutile de connaître d'abord les agents réducteurs et les agents oxydants. Dans une réaction qui implique une réaction d'oxydation et une réduction accompagnée d'un changement du nombre d'oxydation.
Les agents oxydants sont des substances qui peuvent oxyder d'autres substances ou des substances qui sont réduites lorsqu'elles réagissent. Alors que l'agent réducteur est une substance qui peut réduire d'autres substances ou des substances qui subissent une oxydation lors de la réaction.
Lis: Solide
Caractéristiques de la réaction redox
En plus des exemples de réactions redox, d'autres choses que nous devons savoir sont les caractéristiques de cette réaction, les caractéristiques suivantes, entre autres :
- Il existe des agents réducteurs et des agents oxydants
- Il y a un changement d'état d'oxydation
- Il existe des éléments libres tels que le chlore, l'oxygène, le cuivre et autres.
Fonction de réaction redox

Il existe différentes fonctions des réactions redox dans la vie quotidienne, à savoir :
- Afin de comprendre le processus de corrosion des métaux et comment l'empêcher
- Application de boues activées comme traitement des eaux usées
- Processus de photosynthèse des plantes
- Voir l'oxydation des aliments dans les cellules
- Les boulons et les écrous reçoivent un revêtement de zinc, dans cette couche il y a un processus d'oxydation du zinc et une réduction des cations
- Fabriquer des ustensiles de cuisine en acier inoxydable pour qu'ils ne rouillent pas
- Fabrication d'acide sulfurique et traitement du minerai pour les besoins industriels.
Égalisation de la réaction redox

En fait, cette réaction redox se produit dans des solvants aqueux, donc l'équation qu'il a impliquera des ions H+ et OH-. Il existe 2 méthodes utilisées pour l'enseigner, à savoir au moyen de nombres d'oxydation et de demi-réactions.
L'équilibrage des réactions redox peut être effectué en équilibrant les nombres d'oxydation ou les états d'oxydation, à la fois moléculaires et ioniques. Cette méthode d'oxydation est basée sur "La somme de tous les e-oxydés est égale à la quantité totale de e-réduits"
Exemples de réactions redox dans la vie quotidienne

Dans les exemples de problèmes de réaction redox, on trouve souvent des questions pour mentionner les réactions redox dans la vie de tous les jours. Voici des exemples de réactions redox dans la vie de tous les jours, à savoir :
1. Blanchiment des vêtements
L'eau de Javel est un composé qui peut enlever la couleur des objets. Par exemple, le textile. La perte de couleur causée par l'eau de Javel est due à une réaction d'oxydation.
Les agents oxydants souvent utilisés dans les agents de blanchiment sont le peroxyde d'hydrogène et l'hypochlorite de sodium.
2. Processus de photosynthèse des plantes
La photosynthèse est un processus biologique naturel de réaction d'oxydo-réduction. La photosynthèse elle-même est un processus très complexe.
Les organismes issus du processus de photosynthèse peuvent utiliser l'énergie de la lumière du soleil pour produire du sucre et de l'oxygène à partir de réactions redox.
3. Brûlage au propane
Un autre exemple est la combustion. Dans la combustion du propane, l'air contient de l'O2, tandis que les atomes de carbone vont s'oxyder et former du CO2, tandis que l'oxygène deviendra H2O.
Lis: Substance gazeuse
Exemples de problèmes de réaction redox

Publicité
1. Déterminer l'état d'oxydation de l'élément dans le composé SO42- et NaNO3
Réponse:
ALORS42– = ion polyatomique
Oxx d'un ion polyatomique = charge totale = -2
Oxox de O dans le composé = -2
Le bloc S+4. état d'oxydation = -2
-6 + 4. (-2) = -2
Ainsi, le nombre d'oxydation de S = -6 et le nombre d'oxydation de O = -2.
NaNO3 = composé sans charge
Etat d'oxydation total = 0
Oxox de O dans le composé = -2
Oxx de Na (métal) = nombre d'électrons de valence = +1
L'état d'oxydation est Na + le nombre d'oxydation est N + 3. état d'oxydation = 0
+1 + (+5) + 3. (-2) = 0
Ainsi, l'état d'oxydation de Na = +1, l'état d'oxydation de N = +5 et l'état d'oxydation de O = -2
2. Lequel des éléments suivants est l'agent oxydant, l'agent réducteur, l'agent réducteur et le produit de la réaction chimique suivante.
Fe + HCl → FeCl3 +H2
Réponse:
Agent oxydant (réduit) = HCl
Agent réducteur (subissant une oxydation) = Fe
Produit d'oxydation = FeCl3
Résultat de réduction = H2
3. Équilibrez les équations redox suivantes
Bi2O3 + ClO– → 2BiO3– +Cl– (ambiance linguistique).
Réponse:
Comment connaître le nombre d'oxydation
Charge gauche et droite égalisée: 2OH– +Bi2O3 + ClO– → 2BiO3– +Cl–
Le même nombre d'atomes: 2OH– +Bi2O3 + 2ClO– → 2BiO3– + 2Cl– +H2O
Réaction donc équivalente: 2OH– +Bi2O3 + 2ClO– → 2BiO3– + 2Cl– +H2O
Moyen de demi-réaction
Rédox: Bi2O3 + 2ClO– → 2BiO3– + 2Cl–
Équilibrez la charge en ajoutant OH– (base).
2OH– +Bi2O3 + 2ClO– → 2BiO3– + 2Cl–
Équilibrer le nombre d'atomes en ajoutant H2O.
2OH– +Bi2O3 + 2ClO– → 2BiO3– + 2Cl– +H2O
Réaction donc équivalente: 2OH– +Bi2O3 + 2ClO– → 2BiO3– + 2Cl– +H2O
Étudier des exemples de réactions redox et même leur discussion complète n'est pas facile, de plus il y a tellement de composés qui doivent être mémorisés dans ce matériel. Par conséquent, n'hésitez pas à continuer à pratiquer afin de bien le comprendre.
PUBLICITÉ
XFERMER
