Matériel sur la loi de Faraday: sons, formules, exemples de problèmes
Chargement...
Connaissez-vous la loi de Faraday? L'une des lois liées à l'électromagnétisme et fournit des prédictions d'interactions entre les circuits électriques et les champs magnétiques afin qu'ils puissent produire des forces électromotrices.
Découvert en 1833 par le scientifique britannique Michael Faraday, il est jusqu'à présent encore utilisé et très utile dans certains domaines. Vous voulez savoir ce que cela signifie et un exemple de la question ?
Table des matières
1ère loi de Faraday

Il existe deux lois de Faraday, la première concerne le processus d'électrolyse et de charge électrique.
Il lit "La masse de la substance produite à partir d'une électrode pendant le processus d'électrolyse sera directement proportionnelle à la quantité de charge électrique utilisée"
Les équations utilisées sont :
W Q
W = masse d'une substance
Q = charge électrique des électrons
Les utilisations sont :
Q = je x t
i = courant électrique (en ampères)
t = temps (en secondes)
Avec l'explication que la somme de l'utilisation des charges électriques, le résultat sera égal au produit de l'intensité du courant avec le temps.
De plus, il y a plus de similitudes dans les résultats de l'utilisation de la loi ci-dessus, devenant :
w je x ta
Quant à la formule utilisée dans son application sont:
W = e.i.t/F
Informations:
W = masse d'une substance produite lors d'un processus d'électrolyse (en grammes)
e = masse équivalente
i = intensité du courant (en ampères)
t = temps (en sec)
F = détermination de Faraday avec un nombre défini de 96 500 Coulomb/mol.
L'application de la loi de Faraday dans le monde de la chimie peut être vue à travers plusieurs composantes liées au courant électrique et à l'électrolyse.
Comme dans le générateur électrique, qui est un dispositif spécial dont la fonction est de générer de l'énergie électrique à travers des sources mécaniques et d'utiliser l'induction électromagnétique. Les générateurs ont deux types, à savoir le courant circule dans les deux sens et direct.
L'application suivante est une dynamo qui a deux types, à savoir le courant alternatif et le courant continu.
Lis: Loi de Kirchhoff
2e loi de Faraday

Contrairement à la 1ère loi de Faraday, il y a une autre seconde avec le son "La masse de la substance produite par une électrode pendant le processus d'électrolyse, sera directement proportionnelle à la masse équivalente de la substance la.
Alors que ce que l'on entend par la masse d'une substance est la masse d'une substance qui est dans une application de la loi. Alors la masse équivalente est la masse d'une substance, ayant stoechiométriquement le même nombre de moles qu'une mole d'électron.
L'équation est :
Masse de substance équivalent en masse de substance
w MOI
ME = état d'oxydation ou charge de l'ion/Ar
La formule utilisée dans l'application de cette seconde loi est :
W1/W2 = e1/e2
Informations:
W1 = masse de la première substance (en grammes)
W2 = masse de la deuxième substance (en grammes)
e1 = masse équivalente de la première substance
e2 = masse équivalente de la deuxième substance
Dans l'application de cette deuxième loi, la fonction de masse équivalente est très importante. Divisé par le changement du nombre d'oxydation qui se produit dans une réaction d'électrolyse.
L'équation est :
Mchêne = Ar
Changement d'indice d'oxydation
En se référant aux concepts stoechiométriques de base, il existe une relation entre la masse, le nombre de mo et la masse de la molaire qui sera étroitement liée à l'utilisation combinée des 1ère et 2ème lois de Faraday.
L'équation est :
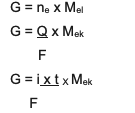
Le résumé est l'équation combinée entre et 2, à savoir :
Publicité
G ~ je x t x Mchêne
Informations:
G = masse du produit (en grammes)
Q = charge électrique (en unités de coulomb)
i = intensité du courant électrique (en ampères)
t = temps (en sec)
Mchêne= masse équivalente de la substance (en grammes/mol)
F = constante de Faraday qui est de 96 500 coulomb/mol)
Lis: La loi de Hooke
Exemple de problème de la loi de Faraday
Pour mieux comprendre l'application de la loi de Faraday, voici quelques exemples de son application.
1. Exemple 1
Il y a eu un dépôt de Cu dans un circuit électrique d'une magnitude de 5 grammes. Quelle masse d'Ag a précipité aux électrodes? Pour plus d'informations, Ag = 108 et Cu = 63,5.
Pour la formule pour trouver la masse de Ag ou WAG vous pouvez utiliser la formule suivante :
OCu = MOICu
OAG= MOIAG
ME est connu par l'équation = UNr
Nombre d'oxydation = 2
Est connu:
OCu = 5 grammes
Calculez d'abord la ME des deux substances en utilisant les réactions de réduction de Cu et Ag comme suit :
Cu2+ + 2e– → Cu(s), MEcu
= UNr = 63,5
Numéro d'oxydation = 2
= 31,75
AG+ + e– → Ag(s) MEAG
= UNr = 108
indice d'oxydation = 1
= 108
5gCu suivants = 31.75
OAG 108
= 17
Donc la masse d'Ag qui se dépose est = 17 grammes.
2. Exemple 2
Combien de Faradays faudra-t-il pour réduire les ions Ca?2+ avec la quantité de 12 grammes? Voici le débat :
Californie2+→ la valence est 2
Ar de Ca est 40
La formule utilisée est W = e x F
Où trouver F = W/e
La réponse est:
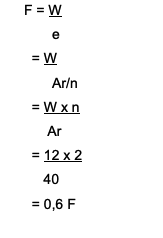
Ainsi, il faut 0,6 Faraday pour réduire les ions Ca.2+ qui équivaut à 12 grammes.
Lis: La loi de coulomb
3. Exemple 3
Un courant électrique de 0,2 ampère est autorisé à circuler pendant une durée de 50 minutes, puis pénètre dans la cellule d'électrolyse contenant une solution de CuCl.2. Quelle est la quantité de précipité de Cu qui se formera à la cathode. Comme information supplémentaire Ar à partir de Cu = 63,5
Est connu:
Courant avec symbole I = 0,2 ampères
Le temps avec le symbole t = 50 minutes, s'il est utilisé comme secondes, est de 50 x 60 secondes, soit 3 000 secondes
Question: WCu?
Réponse: notez d'abord la réaction de réduction du Cu, à savoir :
Cu2+ (aq) + 2e+ → Cu(s)
MOICu = Ar
Indice d'oxydation = 63,5/2
= 31,75
La formule utilisée pour trouver Wcu est:
Ocu = (1/96 500) x je x t x MEcu
= (1/96 500) x 0,2 A x 3 000 s x 31,75
= 0,197 gramme
Ainsi, la valeur du dépôt de Cu qui se produit est de 0,197 gramme.
4. Exemple 4
Dans une électrolyse avec une électrode de type carbone, il a été possible de produire un précipité de type Cu avec une quantité de 12,7 grammes. Utilise un courant électrique de 4 ampères. Combien de temps cela prendra-t-il pour l'électrolyse?
Est connu:
Ar de Cu = 63,5
Question: W ?
Réponse:

Ainsi, le temps d'électrolyse est de 9 650 secondes en utilisant la formule de la loi de Faraday qui s'applique.
Pour ceux d'entre vous qui étudient la chimie, bien sûr, vous aurez vraiment besoin d'une bonne compréhension de la loi de Faraday. Ainsi, lorsqu'on vous confie une tâche liée à l'application de la loi, vous pouvez y répondre correctement et de manière approfondie en utilisant les formules déjà disponibles.
XFERMER
Annonces
PUBLICITÉ
XFERMER
