Stœchiométrie Chimie: Concepts, Types, Exemples de Problèmes
Chargement...
La notion de stoechiométrie est une science de la chimie qui est à la base du calcul de la relation quantitative des réactifs et des produits qui se produisent dans les réactions chimiques. Elle est basée sur l'équation de la réaction et les lois fondamentales.
La caractéristique des réactions stoechiométriques est qu'il n'y a pas de résidu des réactifs ou des réactions car ils ont tous été utilisés. Généralement, ce matériel a été enseigné en 10e année du secondaire et ressort souvent lors de divers examens scolaires. Voici une explication complète.
Table des matières
Matériel de chimie stoechiométrique
Étudier la stoechiométrie signifie avoir à comprendre plusieurs choses liées. Certaines de ces choses incluent les lois fondamentales de la chimie, les concepts de chimie qui sont liés et leurs types. Des questions pratiques sont également nécessaires pour que la compréhension qu'ils ont soit plus mature.
Lois fondamentales de la chimie pour la stoechiométrie
Il existe 5 lois fondamentales en chimie qu'il est important de connaître pour comprendre la stœchiométrie, notamment :
1. Loi de conservation de masse

En 1789, un chimiste nommé Lavoisier formule la loi de conservation de la masse. L'essence de la loi de conservation de la masse est que le poids total possédé par une substance restera le même, à la fois avant et après une réaction chimique.
Par exemple, la masse de bois avant d'être brûlé avec la masse du résultat de la combustion du bois ne change pas. En d'autres termes, la masse d'une substance ou d'un objet possédé avant et après qu'une réaction se produise est conservée.
2. Loi de comparaison fixe

Joseph Proust était un expert qui a créé la loi des proportions fixes en 1799. Cette loi stipule que le rapport du poids total des éléments qui composent un composé particulier ne changera pas ou ne restera pas constant.
A titre d'illustration, le rapport des masses de substance A et de substance B contenues dans une solution est toujours constant et n'est pas du tout affecté par le volume de la solution.
3. Loi de la comparaison multiple

De plus, la loi fondamentale de la stoechiométrie qu'il faut comprendre est la loi des rapports multiples faite par John Dalton en 1803. Les comparaisons multiples sont une extension de la loi de comparaison constante.
La loi des proportions multiples stipule que lorsque 2 éléments forment plus de 2 composés, leur poids total est l'un des éléments constitutifs est constant, alors le poids total des autres éléments constitutifs est un nombre entier Facile.
4. La loi de Gay Lussac
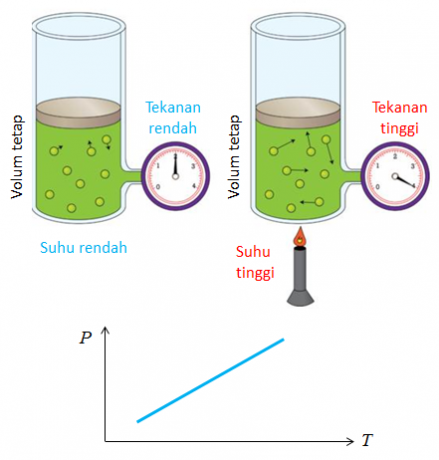
Un autre nom pour la loi découverte par Joseph Gay Lussac est la loi du rapport des volumes. La conclusion obtenue à partir de la loi de comparaison des volumes est que la température et la pression affectent le changement de volume de gaz.
5. L'hypothèse d'Avogadro.
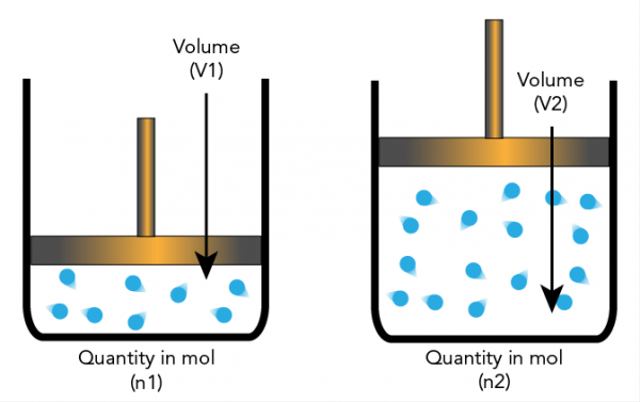
Amadeo Avogadro a émis l'hypothèse que les particules élémentaires peuvent être des molécules et des éléments de sorte qu'elles ne sont pas toujours des atomes. Cela conduit à d'autres explications sur lesquelles la stoechiométrie est basée.
L'hypothèse d'Avogadro stipule que si la température et la pression ont le même nombre, alors le rapport des gaz avec le même volume aura le même nombre de molécules.
Lis: Matériau colloïdal
Concepts chimiques à comprendre en stoechiométrie
Non seulement les lois de base, d'autres choses importantes qui sont étroitement liées au matériau stoechiométrique sont des concepts en chimie. Au moins, il y a 4 concepts qui doivent être compris, à savoir la masse atomique relative, la masse moléculaire relative, la molarité et le concept de taupes.
1. Masse atomique relative (Ar)
En chimie, l'abréviation de la masse atomique relative est Ar. Ce concept fait référence au poids atomique total qui est déterminé en le comparant au poids total atomique standard. L'Union internationale de chimie pure et appliquée utilise l'atome de carbone comme étalon de détermination.
L'atome de carbone ou l'isotope C-12 a été choisi car il possède un noyau stable qui est plus inerte que les autres types d'atomes. Inerte fait référence à la résistance aux réactions chimiques qui se produisent.
2. Masse moléculaire relative (Mr)
De plus, il y a le concept de masse moléculaire relative qui est abrégé en M. Le concept de stoechiométrie Mr est le poids total d'une molécule dont la mesure se fait à l'aide d'unités de masse atomique.
Publicité
Sur la base de ce concept, différentes molécules avec le même composé ont la possibilité de différences de masse moléculaire car les isotopes qu'elles contiennent proviennent d'éléments différents.
3. Mol Concept
La chimie a une unité de compte pour simplifier le processus de calcul, à savoir la mole. Le concept de taupe est basé sur le nombre d'Avogadro pour représenter le nombre de molécules, d'atomes ou d'ions. Selon ce concept, 1 mole équivaut à 6,022 x 1023 les particules de la substance.
On peut dire que la masse d'une mole équivaut à Ar et Mr en grammes. Par exemple, le poids total de la masse molaire du carbone 12 g/mol est égal à Ar du carbone 12 amu.
4. Molarité
La molarité est un concept en chimie qui indique le nombre de moles de soluté présentes dans 1 litre de solvant. En d'autres termes, la molarité fait référence à la concentration possédée par la quantité de soluté par unité de volume.
Lis: Formule de molarité
Types de stoechiométrie chimique

Veuillez noter qu'il existe 3 types de stoechiométrie à savoir les réactions, les gaz et les composés ou compositions. Voici une explication complète :
1. Stœchiométrie de réaction
La définition de la stoechiométrie de réaction est un type de concept qui met l'accent sur la relation quantitative entre les substances présentes dans une réaction chimique particulière. Ce concept est utilisé pour équilibrer les équations chimiques qui se produisent.
Sur la base de cette explication, on peut dire que les substances qui participent à une réaction chimique affectent la relation quantitative entre ces substances.
2. Stœchiométrie des gaz
Ensuite, la stoechiométrie des gaz fait référence au concept de réactions chimiques dans lesquelles des gaz sont présents. Un gaz à une certaine pression, température et volume est considéré comme un gaz parfait. Le gaz est constitué d'un seul ensemble de particules dont le mouvement est aléatoire et n'interagit pas.
L'équation des gaz parfaits est exprimée par P.V = n. R.T. Dans la formule, P est la pression en atm, V est le volume du gaz en litres, n est le nombre de moles, T est la température de 273 K et R est le gaz 0,082 L atm/mol K.
3. Stœchiométrie composée
La définition de la stoechiométrie d'un composé ou d'une composition est un concept qui exprime la relation quantitative du poids total ou de la quantité de substance que possèdent les éléments d'un composé particulier.
Ce concept est souvent utilisé pour expliquer le poids total d'hydrogène et d'azote qui se sont combinés pour former de l'ammoniac complexe.
Lis: Formule de densité
Exemples de problèmes de stoechiométrie et discussion

Comment résoudre les problèmes liés à la stoechiométrie. Voici un exemple de question et sa discussion pour faciliter la compréhension :
1. Trouver le nombre de chaque atome contenu dans 2 moles de H2Ô !
Il est à noter que H2O a 2 atomes H et 1 atome O. Alors la solution devient :
Le nombre d'atomes H = 2 2 mol 6,02. 1023 atomes/mole = 24,08. 1023 atome. Ainsi, le nombre d'atomes contenus dans 2 moles de H est de 24,08. 1023.
Maintenant, il suffit de compter le nombre d'atomes appartenant à l'atome O, à savoir :
Le nombre d'atomes O = 1 2 mol 6,02. 1023 atomes/mole = 12,04. 1023 atome. Sur la base de ces calculs, on peut voir que le nombre d'atomes dans 2 moles d'O est de 12,04. 1023.
2. Calculer le poids total ou la masse possédée par 2 moles de C6H12O6 (glucose)! On sait aussi que la somme de Ar C = 12, O = 16 et H = 1.
La solution:
De la question, on peut voir les informations suivantes:
n = 2 mol
Monsieur C6H12O6 = (6 ArC) + (12 1) + (6 16)
= 180
Ensuite, le calcul devient :
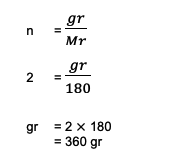
Ainsi, le poids total de 2 moles de glucose ou C6H12O6 jusqu'à 360 grammes sur la base de ces calculs.
L'un des sujets importants en chimie est la stoechiométrie qui est le concept de base du calcul pour découvrir la relation quantitative entre les équations chimiques et les formules. Plusieurs autres concepts en chimie doivent également être compris car ils sont liés à la stoechiométrie.
XFERMER
Annonces
PUBLICITÉ
XFERMER
