HEAT: formules, types, exemples de problèmes (résumé)
Chargement...
La formule de la chaleur est une chose familière à trouver dans les cours de physique. La chaleur est une forme d'énergie qui peut être reçue ou libérée par un objet. La chaleur a des unités appelées joules ou calories.
La chaleur peut être interprétée comme l'énergie thermique possédée par certaines substances et peut être détectée en mesurant la température de l'objet. Vous pouvez voir l'application de chaleur pour réchauffer l'eau laissée ouverte, se refroidissant progressivement (ne se réchauffant plus) car la chaleur est libérée de l'eau dans l'air.
Table des matières
Définition des calories

La chaleur est une énergie qui peut se déplacer d'un objet avec une température plus élevée vers un objet avec une température plus basse lorsque les deux objets se touchent ou sont rapprochés. Deux objets avec des températures différentes feront circuler et déplacer la chaleur.
Par exemple, lorsque vous mélangez de l'eau chaude et de l'eau froide, l'eau qui se combine devient de l'eau chaude. Vous devez également comprendre que la température et la chaleur sont deux choses différentes. La température est une valeur qui peut être mesurée avec un thermomètre, tandis que la chaleur est une énergie qui circule.
Selon le système international (SI) ou MKS, l'unité de chaleur est le joule (J), tandis que selon le CGS, l'unité de chaleur est l'erg. Pour un certain nombre de types d'aliments, la chaleur utilise l'unité de calorie.
Une calorie est définie comme la quantité d'énergie thermique nécessaire pour élever la température de 1 gramme d'eau à 1 degré Celsius. Ainsi, on peut conclure que 1 calorie = 4,184 Joules ou généralement arrondi directement à 4,2 J.
Formule calorique
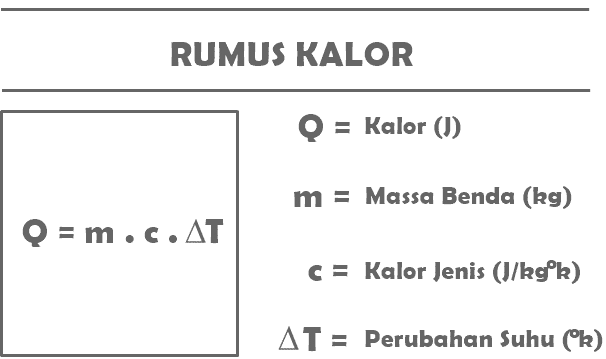
Selon la définition de la chaleur que vous avez lue ci-dessus, voici quelques-unes des formules qui ont été résumées concernant le matériau thermique dans les matières de physique.
1. Formule de transfert de chaleur
Q = m. c. J
Avec:
Q = la quantité de chaleur reçue ou dégagée par un certain objet (J)
m = masse de l'objet recevant ou dégageant de la chaleur (kg)
c = chaleur spécifique de la substance (J/kg°C)
T = changement de température (°C)
2. Formule de chaleur spécifique
La référence de cette formule est la formule de transfert de chaleur, en supprimant l'élément c (chaleur spécifique de la substance) à calculer mathématiquement comme d'habitude.
c = Q / (m. T)
Avec:
c = chaleur spécifique de la substance (J/kg°C)
Q = la quantité de chaleur reçue ou dégagée par un certain objet (J)
m = masse de l'objet recevant ou dégageant de la chaleur (kg)
T = changement de température (°C)
3. Formule de capacité thermique
C = Q / T
Avec:
C = capacité calorifique (J/°K)
Q = beaucoup de chaleur (J)
T = changement de température (Kelvin / K)
4. Formule pour déterminer la capacité thermique
C = m. c
Avec:
C = capacité calorifique (J/°K)
m = masse de l'objet recevant ou dégageant de la chaleur (kg)
c = chaleur spécifique de la substance (J/kg°K)
5. Chaleur de fusion et formule de vapeur
La formule de la chaleur de fusion est la suivante.
Q = m. L
La formule de la chaleur de vapeur est la suivante.
Q = m. tu
Avec:
Q = beaucoup de chaleur (J)
m = masse de l'objet (kg)
L = chaleur de fusion (J/kg)
U = chaleur de vapeur de la substance (J/kg)
Lis: Thermodynamique
Types de Calories

Il existe plusieurs types de chaleur qui se distinguent en fonction du processus de travail dans une substance particulière. Vous trouverez ci-dessous les types de chaleur que vous devez comprendre pour pouvoir voir son application dans la vie de tous les jours.
1. Chaleur de formation (ΔHf)
La chaleur de formation est la chaleur produite ou nécessaire pour former 1 mole d'un composé dans ses éléments, tels que les gaz, qui sont écrits à l'aide de la formule moléculaire. Quelques exemples de chaleur de formation sont C12, O2, Br2, H2.
2. Chaleur de décomposition (ΔHd)
La chaleur de décomposition est la forme de chaleur produite ou nécessaire pour décomposer 1 mole d'un composé en un autre élément.
3. Chaleur de combustion (ΔHc)
La chaleur de combustion est la chaleur acquise ou nécessaire pour brûler 1 mole d'une substance, telle qu'un élément ou son composé.
4. Chaleur de neutralisation (ΔHn)
La chaleur de neutralisation est le type de chaleur obtenue ou nécessaire pour former une mole de H2O de la réaction entre un acide et une base. Cette chaleur est une réaction exothermique car il y a une augmentation de la température.
5. Chaleur de dissolution (ΔHs)
La chaleur de dissolution est le type de chaleur produite ou nécessaire pour dissoudre 1 mole d'une substance qui était à l'origine solide dans une solution.
Lis: Formule de densité
Chaleur spécifique et capacité thermique
Vous devez également savoir que la chaleur peut circuler dans deux substances qui ont des particules de matière différentes et des changements de température différents. Par exemple, lorsque l'eau et l'huile sont chauffées à la même température, la température de l'huile change plus que la température de l'eau ne change.
Cela peut arriver parce qu'il existe différents types de chaleur dans deux objets qui sont rapprochés ou assemblés. La chaleur spécifique est la quantité de chaleur nécessaire pour élever la température de 1 kg de masse à 1°C, l'unité est calories/gramme°Celcius ou J/kg°C.
Chaque substance a sa propre chaleur spécifique et il y a des différences dans celle-ci. Quant à la notion de capacité calorifique, c'est la quantité de chaleur nécessaire ou absorbée pour pouvoir élever la température d'un objet à 1°C.
Changement de chaleur
Dans son application, la formule de la chaleur fonctionne selon le principe qui modifie deux substances mises en présence ou en contact l'une avec l'autre. Ci-dessous, un changement de chaleur qui se produit lorsqu'il y a des substances qui sont assemblées ou réunies.
1. La chaleur peut modifier la température d'une substance
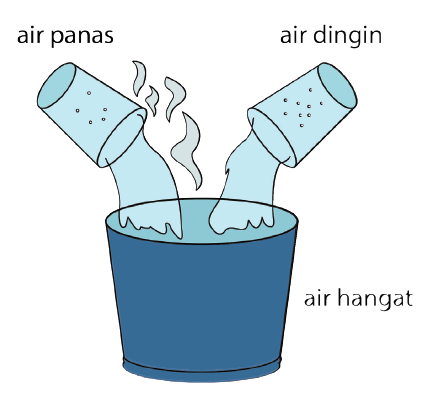
Chaque objet de base a une température inférieure au zéro absolu, donc l'objet doit avoir de la chaleur. Ce contenu déterminera plus tard la quantité de chaleur de la température de l'objet.
Lorsque l'objet est chauffé, il obtiendra une chaleur supplémentaire. La température augmentera ou augmentera également. À l'inverse, si l'objet est refroidi, de la chaleur sera libérée et provoquera une diminution de la température.
2. La chaleur peut modifier les substances

Dans certains types d'objets, lorsqu'on leur donne de la chaleur dans certaines unités, l'objet peut subir un changement d'état. Par exemple, si la glace reçoit de la chaleur (chauffée), la glace changera de forme solide en liquide ou même en gaz.
Si le processus de chauffage est effectué en continu, c'est ce qui fait que l'eau redevient une substance. Cela se produit lorsque l'objet qui est sur le point de changer de forme se déplace du point du liquide au point de fusion de l'objet.
Types de transfert de chaleur
Après avoir expliqué la définition, les types, les formules de chaleur, les changements de chaleur, vous pouvez conclure que la chaleur peut également se déplacer lorsqu'elle rencontre ou entre en contact avec d'autres objets. Voici quelques types de transfert de chaleur.
1. Conduction

Le transfert de chaleur par conduction se produit lors du passage à travers une substance intermédiaire telle qu'un métal, mais n'est pas suivi d'un mouvement permanent de particules dans la substance. Par exemple, lorsque vous chauffez une extrémité d'un métal, l'autre extrémité du métal devient également chaude.
Cela est dû à la conduction de la chaleur d'une température élevée à une température plus basse. La pointe métallique chauffée fera que les particules métalliques créeront des vibrations dans d'autres particules qui leur sont connectées.
Par conséquent, toutes les particules métalliques vibrent même si une seule extrémité du métal est chauffée, ce qui provoque alors un transfert de chaleur. Un autre exemple est lorsque l'échappement de la moto est chaud lorsque le moteur est allumé.
La conduction se produit également lorsque vous tenez les feux d'artifice en feu, tenez le couvercle d'une casserole qui semble chaude pendant le processus de cuisson, le beurre qui fond lorsqu'il est chauffé, etc. La formule de transfert de chaleur pour la conduction est la suivante.
Taux de chaleur = Q/t = kA. T / x
2. Convection
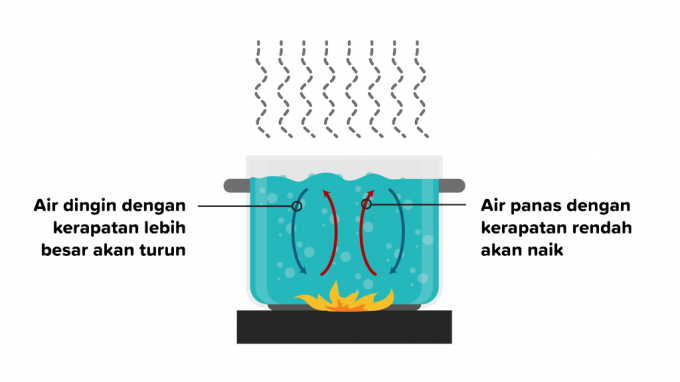
La convection est le transfert de chaleur dans lequel la chaleur traverse une substance et est suivie par le mouvement de parties de la substance. Le transfert de chaleur par convection peut se produire dans des liquides ou des gaz, de sorte que la convection est divisée en deux comme suit.
un. Convection scientifique
La convection est un transfert de chaleur qui se produit en raison de la flottabilité sans facteurs externes et qui est influencé par différents types d'objets. Un exemple de cas est lorsque l'on chauffe de l'eau, la densité des particules d'eau chaude s'éloignera du feu, puis une substance aqueuse à plus basse température la remplacera.
b. Convection forcée
Publicité
La convection est un transfert de chaleur provoqué par l'influence de facteurs externes, tels que la pression, de sorte que le transfert se produit intentionnellement ou forcé. C'est-à-dire que la chaleur est forcée de se déplacer vers un endroit à cause de l'aide.
Des exemples de cas sont lorsqu'un ventilateur produit de l'air froid dans un endroit chaud, le système de refroidissement du moteur sur le radiateur de la voiture, etc.
Une autre application de la convection se produit lors du chauffage de l'eau, où il y a un mouvement de haut en bas de l'eau, des graines de haricots verts qui monte et descend lorsqu'il est bouilli, le processus des brises de terre et de mer, le mouvement des ballons à air chaud, la fumée de cheminée usine.
La formule du transfert de chaleur par convection est la suivante.
Taux de chaleur = Q/t = hA. J
3. Radiation

Le rayonnement est le transfert de chaleur qui ne nécessite pas de substance ou de milieu intermédiaire. Le transfert de chaleur par rayonnement n'est pas la même chose que la conduction et la convection. Le déplacement dans le rayonnement ne fait pas toujours entrer en contact ou se rencontrer les deux substances, car la chaleur peut se transférer même sans intermédiaire.
C'est-à-dire que la chaleur sera rayonnée dans toutes les directions par la source de chaleur elle-même, puis s'écoulera dans toutes les directions possibles. Fondamentalement, tous les objets peuvent émettre et absorber un rayonnement thermique, mais la quantité dépend de la température et de la couleur de la substance.
Plus un objet est plus chaud que la température qui l'entoure, plus il dégage de chaleur dans son environnement. Ainsi, si la surface d'un objet chaud est plus grande, la chaleur qui sera rayonnée sera plus chaude.
Un exemple de cas de rayonnement dans la vie quotidienne est lorsque vous faites un feu de joie, il se sentira chaud Étant donné que la source de feu se trouve à une certaine distance, le rayonnement se fait sentir lorsque les paumes deviennent chaudes lorsqu'elles sont rapprochées avec du feu. La formule de chaleur pour le rayonnement est la suivante.
Taux de chaleur = Q/t = eσAT4
4. Isoler la chaleur

La chaleur a la propriété d'être facilement transférée. Vous pouvez empêcher le mouvement de se produire, que ce soit par conduction, convection et rayonnement. Par exemple en isolant la pièce; Le thermos peut maintenir la température de l'eau chaude ou tiède, de sorte que le transfert de chaleur peut être évité.
Lis: Substance gazeuse
Exemple de problème de calories

La formule de la chaleur est une méthode que vous pouvez utiliser pour travailler sur les exemples de questions suivants !
1. Exemple Question 1
Un objet a une température de 5°C et absorbe 1500 J de chaleur. La température de l'objet passe à 32°C. Calculez la capacité calorifique de l'objet !
La solution:
Q = 1500J
T = 32°C – 5°C = 27°C = 300°K
C = Q / T
C=1500/300
C = 5 J/°K
2. Exemple Question 2
Calculez la chaleur nécessaire pour chauffer 5 kg d'eau de 25°C à 105°C si l'on sait que la chaleur spécifique de l'eau est de 1000 J/kg°C !
La solution:
m = 5 kg
c = 1000 J/kg°C
T = 105°C – 25°C = 80°C
Q = m. c. J
Q = 5. 1000. 80
Q = 400 000 J
3. Exemple Question 3
Si une eau a une masse de 3 kg et est chauffée de 30°C à 100°C et que sa chaleur spécifique est de 1 J/g°C, calculez la quantité de chaleur nécessaire à l'eau !
La solution:
m = 3 kg
c = 1 g/°C = 1000 J/kg°C
T = 100°C – 30°C = 70°C
Q = m. c. J
Q = 3. 1000. 70
Q = 210 000 J
4. Exemple Question 4
Un liquide a une masse de 5 kg. Le liquide nécessite une chaleur de 200 000 J et est chauffé de 20°C à 80°C. Calculez la chaleur spécifique du liquide !
La solution:
m = 5 kg
Q = 200 000 J
T = 80°C – 20°C = 60°C
c = Q/m. J
c = 200 000 / 5. 60
c = 200 000 / 300
c = 666,67 J/kg°C
5. Exemple Question 5
Un aluminium a une masse de 5 kg. La température initiale est de 25°C. Si l'aluminium reçoit 250 000 J de chaleur et que sa chaleur spécifique est de 900 J/kg°C, calculez la température finale de l'aluminium !
La solution:
m = 5 kg
Q = 250 000 J
c = 900 J/kg°C
J1 = 25°C
Q = m. c. J
250.000 = 5. 900. (T2 – 25)
J2 – 25 = 250.000 / 5. 900
J2 – 25 = 250.000 / 4.500
J2 – 25 = 55,56
J2 = 55,56 + 25 = 80,56 °C
6. Exemple Question 6
Il y a 300 grammes d'eau à une température de 25°C, qui seront chauffées avec une énergie de 1500 calories. Si la chaleur spécifique de l'eau est de 1 cal/g°C, calculez la température de l'eau après qu'elle ait été chauffée !
La solution:
m = 300 grammes
J1 = 25°C
c = 1 cal/g°C
Q = 1 500 cal
Q = m. c. J
1.500 = 300. 1. (T2 – 25)
J2 – 25 = 1500 / 300. 1
J2 – 25 = 5
J2 = 5 + 25 = 30°C
7. Exemple Question 7
Il y a 300 grammes d'eau à chauffer de 40°C à 65°C. Si la chaleur spécifique de l'eau est de 1 cal/g°C ou 4 200 J/kg°K, calculez :
- Beaucoup de chaleur est reçue en calories
- Combien de chaleur est reçue en Joules
La solution:
m = 300 g = 0,3 kg
T = 65 – 40 = 25°C
c = 1 cal/g°C = 4 200 J/kg°K
- Calories en calories
Q = m. c. J
Q = 300. 1. 25
Q = 7 500 calories
- Chaleur en Joules
Q = m. c. J
Q = 0,3. 4.200. 25
Q = 31 500 calories = 132 300 Joules
Sur la base de l'explication ci-dessus, la formule de la chaleur ne tourne pas seulement autour de la libération et de l'exigence chaleur, mais il y a un changement de chaleur, un transfert de chaleur, même la chaleur spécifique de chaque substance qui varier. Bonne pratique et j'espère que cet article vous sera utile !
XFERMER
Annonces
PUBLICITÉ
XFERMER
