Matériel de nombre quantique: types, exemples de problèmes (résumé)
Chargement...
Lorsqu'il est expliqué simplement, le nombre quantique est un nombre qui décrit la position des électrons et des niveaux d'énergie ou la distance du noyau atomique à la fois, la forme des orbitales, l'orientation des orbitales et le spin des électrons contenus dans le modèle atomique mécanique Quantum.
Chaque atome a une orbitale et les orbitales atomiques ont des niveaux d'énergie différents. Le niveau d'énergie de la même orbitale aura un niveau d'énergie différent si les atomes sont différents, de sorte que l'orbitale 1s pour l'hydrogène diffère en niveau d'énergie de l'orbitale 1s pour l'hélium.
Table des matières
Définition des nombres quantiques

Dans la fonction d'onde, ce nombre a une signification particulière pour décrire l'état de la situation quantique. Ces nombres peuvent décrire l'état des électrons dans l'atome. En 1926, Erwin Schrodinger a proposé la théorie de la mécanique quantique.
Cette théorie explique la structure de l'atome. Ce modèle atomique de mécanique quantique est exprimé dans une équation mathématique, à savoir l'équation d'onde. La résolution de l'équation de l'atome d'hydrogène donne une fonction d'onde ou une orbitale atomique.
Cette orbitale atomique décrira la situation du nombre quantique d'électrons dans l'atome. Le carré de la fonction d'onde signifie qu'il y a une forte probabilité d'obtenir un électron dans un volume d'espace donné autour du noyau atomique.
Comme avec le principe d'incertitude de Heisenberg, la position des électrons dans les atomes ne peut pas être déterminée. Tout ce qui peut être connu est la position où l'électron est le plus susceptible de se trouver.
Types de nombres quantiques
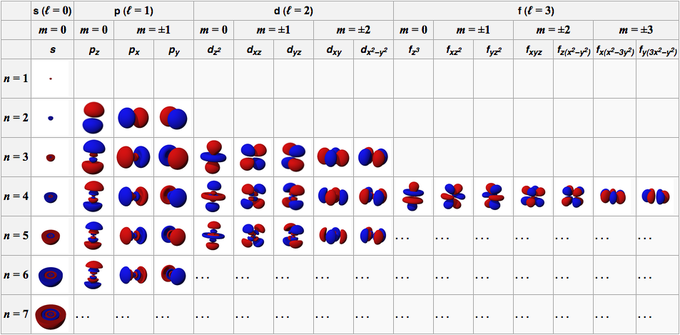
L'orbite d'un atome est formée à partir des fonctions d'onde qui composent l'orbite. Dans des conditions générales, les caractéristiques orbitales d'un atome sont décrites par quatre nombres, à savoir n, l, m et s.
1. Nombre quantique principal (n)
Ce nombre est composé d'entiers positifs à partir de 1 (un), ce qui fait que la valeur de n est 1, 2, 3, 4, 5, etc. Ce nombre fait référence à la coquille occupée par une orbitale dans un atome.
2. Nombre quantique d'azimut (l)
Ce nombre est composé d'entiers positifs commençant à 0 (zéro), faisant de l la valeur 0, 1, 2, 3, 4, 5, etc. Ces nombres ont leur propre signe; 0 est l'orbite s, 1 est l'orbite p, 2 est l'orbite d et 3 est l'orbite f.
3. Nombre quantique magnétique (m)
Ce nombre est composé d'entiers commençant de 0 (zéro) à +/- 1, de sorte que la valeur numérique pour chaque orbitale n'est pas la même. Pour l'orbitale s, alors m vaut 0 car il est dans l'orbitale s, alors l vaut 0. Cependant, pour les orbitales d où l vaut 2, alors m vaut -2, -1, 0, 1 et 2.
4. Nombre(s) quantique(s) de spin
Si le nombre précédent indique l'orientation des orbitales, ce nombre décrit le spin de l'électron qui a des valeurs de 1/2 et -1/2.
Lis: Mécanique quantique
Orbitales et nombres quantiques
Chaque orbitale atomique possède un ensemble unique de trois nombres quantiques. Ces nombres sont le nombre quantique principal (n), l'azimut ou le moment cinétique (l) et le magnétique (m). Ces trois chiffres illustrent plusieurs choses.
Il s'agit notamment de décrire le niveau d'énergie des orbitales, la taille, la forme et l'orientation de la distribution radiale possible des orbitales atomiques. Ensuite, il y a le(s) nombre(s) de spin, un nombre qui vous indique le spin d'un électron dans une orbitale.
Forme orbitale atomique
Il existe quatre formes d'orbitales atomiques basées sur leurs valeurs de nombre d'azimut. Les quatre formes orbitales sont les suivantes.
1. s orbitales
L'orbitale s est une orbitale avec l = 0. Il est de forme sphérique, avec le noyau atomique au centre. Puisque la sphère n'a qu'une seule orientation, toutes les orbitales S n'ont qu'une seule valeur de m, c'est-à-dire m = 0. L'orbite 1s a la densité ou la densité d'électrons la plus élevée dans le noyau atomique.

La densité atomique diminue ensuite lentement à mesure qu'elle s'éloigne du noyau atomique. L'orbite 2s a deux régions de haute densité électronique. À partir des deux régions, il y a un nœud sphérique, où la probabilité de rencontrer des électrons dans cette région diminue jusqu'à zéro.
Le modèle d'augmentation des sommets orbitaux s continuera avec les 4s, 5s, et ainsi de suite.
2. p. orbitales
L'orbitale p est une orbitale avec l = 1. La forme ressemble à un ballon torsadé, équipé de deux lobes. Les lobes sont sur les côtés opposés du noyau atomique. Le noyau atomique se trouve dans le plan du nœud orbital p, entre les deux lobes à haute densité électronique.

L'orbitale p a trois types d'orientation spatiale, à savoir Px, Py et Pz, il existe donc trois valeurs possibles de m, à savoir -1, 0 ou +1. Les trois orbitales sont situées perpendiculairement les unes aux autres sur les axes x, y et z en coordonnées cartésiennes. La forme, la taille et l'énergie sont les mêmes.
3. d orbitale
L'orbitale d est une orbitale avec l = 2. Cette orbitale a cinq orientations différentes, ce qui lui donne cinq valeurs possibles de m, à savoir -2, -1, 0, +1 ou +2. Les quatre orbitales d sont dxy, dxz, dyx et d2-y2.
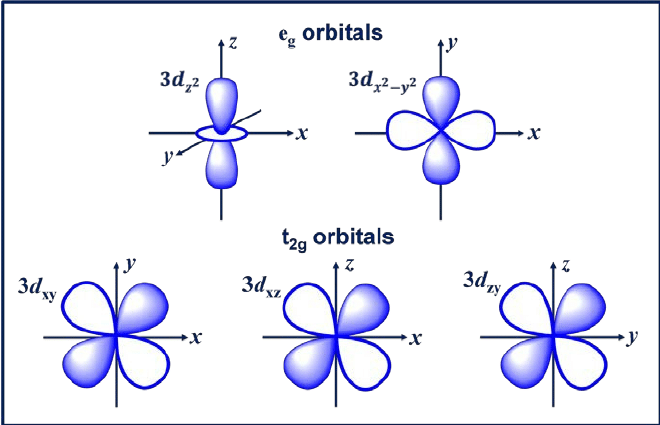
Ces orbitales ont quatre lobes en forme de feuille de trèfle. La prochaine orbitale d est dzw, qui a deux lobes principaux sur l'axe z et une section en forme de beignet au milieu.
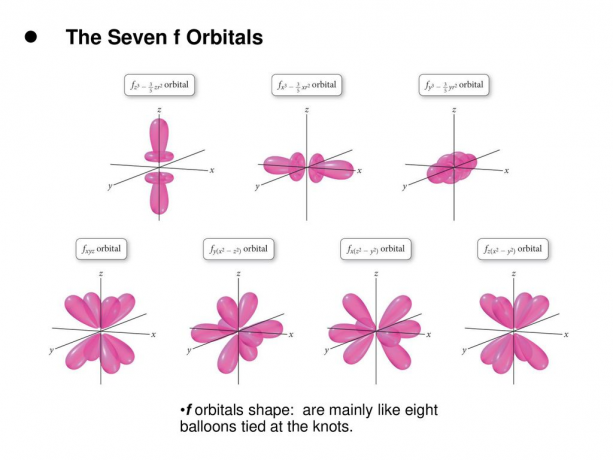
4. f. orbitales
L'orbitale f est une orbitale avec l = 3. Cette orbitale a sept types d'orientation, tout comme il existe sept valeurs possibles de m (2l + 1 = 7). Toutes les orbitales f ont des formes complexes avec un nombre variable de lobes.
Lis: Configuration électronique
Configuration électronique
Après avoir compris comment la relation entre l'existence d'électrons dans les atomes et les orbitales dans la théorie atomique de la mécanique quantique, Ensuite, vous apprendrez la configuration électronique, comment organiser les électrons en orbitales dans les coquilles atomiques multi-électron.
1. La règle d'Aufbau
Publicité
Dans cette règle, il est indiqué que les électrons doivent être remplis des niveaux d'énergie inférieurs aux niveaux supérieurs. Les niveaux d'énergie des orbitales peuvent être vus dans l'arrangement des atomes dans le tableau périodique des éléments chimiques.
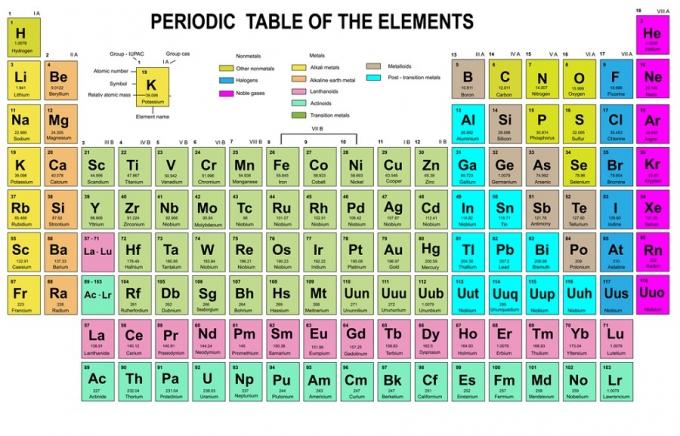
Dans le tableau, le bas à gauche est écrit en rouge là où il y a un bloc s, le bleu est pour le bloc d, le jaune est pour le bloc p et le vert est pour le bloc f. Alors que chaque rangée est une peau.
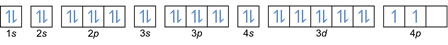
Sur la base de cet arrangement, vous pouvez voir que l'ordre des niveaux d'énergie est 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, etc.
2. Règles de cent
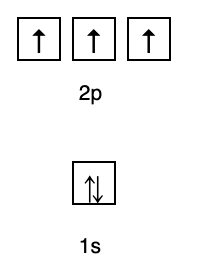
Cette règle stipule que s'il y a des orbitales au même niveau d'énergie, alors les électrons doivent être rempli en parallèle jusqu'à ce que toutes les orbitales du même niveau d'énergie soient remplies d'électrons, comme le montre la figure Suivant.
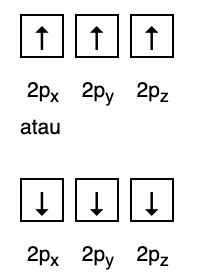
Pendant ce temps, la figure suivante n'est pas conforme au remplissage selon la règle de Hund.
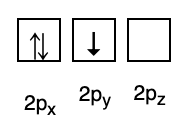
3. L'interdiction de Pauli
L'interdiction de Pauli stipule que les électrons ne peuvent pas avoir le même nombre quantique lorsqu'ils sont remplis dans une orbitale, il existe donc un ou plusieurs nombres de spin d'une valeur de +1/2. L'énergie la plus basse est celle avec le plus grand nombre d'électrons appariés et de spins parallèles.
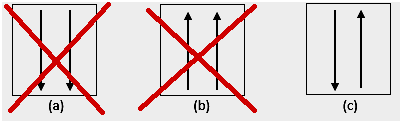
4. Anomalie

Selon les expériences, il existe des anomalies dans la configuration électronique selon les règles susmentionnées. Le sous-shell d est généralement à moitié plein ou plein. Par exemple, pour 24Cr, sa configuration électronique: [Ar] 4s1 3d5, est plus stable que [Ar] 4s2 3d4.
De plus, la configuration électronique de 29Cu: [Ar] 4s1 3d10, plus stable que [Ar] 4s2 3d9. Pendant ce temps, la configuration électronique des ions monoatomiques tels que K+, N / A+, Californie2+, Br–, S2-, et ainsi de suite peut être déterminé par l'atome neutre en premier.
Pour les cations ou ions chargés positivement, monoatomique Ax+ avec une charge de x+, alors jusqu'à x électrons sont retirés de la couche externe d'électrons de l'atome neutre A. Quant à l'anion, monoatomique Bv- avec une charge y, jusqu'à y électrons sont capturés dans l'orbite d'énergie la plus basse qui n'est pas encore pleine.
Comment déterminer les nombres quantiques
Avant de déterminer le nombre, vous devez d'abord faire la configuration électronique de l'élément dont vous voulez trouver la valeur quantique. Par exemple est 16S Sa configuration électronique est 1s2 2s2 2p6 3s2 3p4. Après cela, prenez la dernière configuration électronique, qui est 3p4.
- Sur la base de cette configuration, la valeur numérique principale est 3, car le nombre 3 représente la taille de l'orbite ou de l'obus.
- p est une sous-couche de l'électron, il peut donc être obtenu sous la valeur de l = 1.
- Comme il se trouve dans la sous-couche p, le nombre quantique sera compris entre -1, 0 ou +1. Pour le déterminer, dessinez d'abord la boîte orbitale. Vous pouvez utiliser les flèches pour remplir la case.
- Remplissez chaque case avec une flèche pointant vers le haut, puis remplissez-la avec une flèche pointant vers le bas. Le nombre 4 est le nombre de flèches qu'il faut remplir, pour ensuite être obtenu comme ça.
↑↓ ↑ ↑
-1 0 +1
- La quatrième (dernière) flèche se trouve dans la case -1, où la valeur mécanique est m = -1.
- La flèche vers le haut vaut +1/2, tandis que la flèche vers le bas vaut -1/2. La dernière flèche est celle qui pointe vers le bas, donc la valeur de s = -1/2.
Eh bien, c'est ainsi que l'on détermine le nombre quantique. Voici quelques exemples de questions liées à ce matériel que vous pourrez étudier.
Lis: Changement physique
Exemples de nombres quantiques

Consultez les questions suivantes!
1. Exemple Question 1
Déterminez les configurations électroniques et les diagrammes électroniques des éléments et ions monoatomiques suivants !
- 8O2-
- 20mg2+
- 26Fe3+
- 27Co
- 32Ge
La solution:
- Configuration électronique 8O2:1s2 2s2 2p4 ou [Il] 2s2 2p4
Configuration électronique 8O2–: 1s2 2s2 2p6 ou [Il] 2s2 2p6 ou [Ne] (plus 2 électrons: 2s2 2p4+2)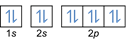
- Configuration électronique 20Mg: 1 s2 2s2 2p6 3s2 3p6 4s2 ou [Ar] 4s2
Configuration électronique 20mg2+: 1s2 2s2 2p6 3s2 3p6 ou [Ar] (soustraire 2 électrons de la coque externe: 4s2-2)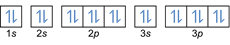
- Configuration électronique 26Fe: 1s2 2s2 2p6 3s2 3p6 4s2 3d6 ou [Ar] 4s2 3d6
Configuration électronique 26Fe3+: 1s2 2s2 2p6 3s2 3p6 3d5 ou [Ar]3d5 (soustraire 3 électrons de la coque externe: 4s2-2 3d6-1)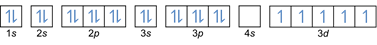
- Configuration électronique 27Co: 1s2 2s2 2p6 3s2 3p6 4s2 3d7 ou [Ar] 4s2 3d7
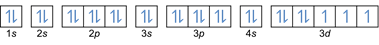
- Configuration électronique 32Ge: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p2 ou [Ar] 4s2 3d10 4p2
2. Exemple Question 2
Le dernier électron de Ga a un nombre quantique...
- n = 4; l = 0
- n = 4; l = 1
- n = 3; l = 2
- n = 4; l = 2
- n = 3; l = 1
La solution:
Si vous regardez le tableau périodique chimique des éléments, l'élément Ga est dans la période IV, ce qui lui donne un n = 4. Le gallium est dans le groupe 13, donc les électrons de valence sont dans la sous-couche p, ce qui signifie l = 1.
3. Exemple Question 3
Ci-dessous, le nombre quantique qui ne peut être occupé par le dernier électron de l'atome Cl, est...
- n = 3; l = 1; m = -1; s = -1/2
- n = 3; l = 1; m = 0; s =
- n = 3; l = 2; m = -1; s =
- n = 3; l = 2; m = 1; s = -1/2
- n = 3; l = 1; m = 1; s = 1/2
La solution:
Puisque l'élément Cl est dans la période 3, alors n = 3. Cl est également un groupe 17, donc ses électrons de valence sont dans la sous-couche p, donc l = 1. La valeur de m peut être -1, 0 ou +1 car les énergies des trois nombres quantiques sont les mêmes et l'ordre de remplissage n'a pas d'importance.
Car s peut aussi valoir -1/2 ou 1/2, on ne peut donc pas déterminer m et s avec certitude.
4. Exemple Question 4
Un élément X3+ a la même configuration électronique que l'élément Ar. Ainsi, l'ion qui a la même configuration que l'ion est...
- K+
- mg2+
- N / A+
- CL+
- F–
La solution:
L'élément Ar est dans la Période 3, donc l'ion ayant la même configuration électronique que Ar ou [Ne] 3s2 3p6 sera en Période 4 pour les cations et en Période 3 pour les anions. L'ion le plus approprié est K+.
5. Exemple Question 5
Déterminer le nombre quantique de l'élément 32Gé !
La solution:
Configuration électronique 32Ge: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p2 ou [Ar] 4s2 3d10 4p2.
La dernière configuration est 4p2. Le niveau d'énergie est 4 et se trouve dans la sous-couche p, donc n = 4 et l = 1. 4p. dessin de diagramme orbital2 connaître les autres nombres comme suit.
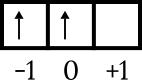
Le dernier électron est dans la case orbitale 0, la flèche pointe vers le haut, donc m = 0 et s = +1/2.
6. Exemple Question 6
Tous les nombres suivants sont des nombres quantiques autorisés, sauf...
- n = 2; l = 1; m = -1
- n = 3; l = 2; m = 1
- n = 3; l = 3; m = -1
- n = 3; l = 0; m = 0
- n = 3; l = 2; m = -1
La solution:
Si la valeur du nombre principal (n) est 3, alors le nombre d'azimut maximal (l) est n-1 = 3-1 = 2. Par conséquent, les options C avec n = 3, l = 3 et m = -1 ne sont pas autorisées.
Pour apprendre les nombres quantiques, vous devez également maîtriser certains des numéros atomiques des éléments qui sont souvent utilisés ou qui apparaissent dans les problèmes. De plus, vous devez être familiarisé avec la disposition des niveaux d'énergie lors de la construction de configurations d'électrons.
XFERMER
Annonces
PUBLICITÉ
XFERMER
