Exemple de problème de molalité: fraction molaire, formule et solution
Exemple de problème de molalité: fraction molaire, formule et solution - À cette occasion À propos du knowledge.co.id discutera de la molalité avec plusieurs exemples de questions et bien sûr d'autres choses qui la couvrent également. Regardons ensemble la discussion dans l'article ci-dessous pour mieux la comprendre.
Exemple de problème de molalité: fraction molaire, formule et solution
La molalité ou concentration molaire est une mesure de la concentration d'un soluté dans une solution en termes de quantité de substance dans une certaine masse de solvant. Ceci est différent de la définition de la molarité qui est basée sur un certain volume de solution.
L'unité commune de molalité en chimie est mol/kg. Une solution avec une concentration de 1 mol/kg est aussi parfois exprimée en 1 molal. Le terme molalité est formé par analogie avec la molarité qui est la concentration molaire d'une solution.
La molalité d'une solution peut être testée en ajoutant du solvant. Plus simplement, la molalité (m) d'une solution correspond aux moles de soluté divisées par les kilogrammes de solvant. La molalité ou molalité est la concentration d'une solution qui indique le nombre de moles (n) de soluté dans 1 kg ou 1000 grammes de solvant.
La différence entre la molalité et la molarité est que si la molalité est la molalité ou la concentration molaire (m) exprime le nombre de moles soluté dans 1000 grammes de solvant tandis que la molarité est une déclaration du nombre de moles de soluté dans chaque litre solution. La molarité est représentée par la notation M et les unités sont les moles/litre.
Formule Molalité
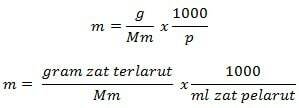
Information
m = molalité (mol/kg)
g = grammes de soluté (g)
Mm = masse molaire de la substance (g/mol)
P = masse de solvant (g)
Relation de molalité avec le pourcentage de masse
Le pourcentage en masse est une unité de concentration couramment utilisée dans les solutions chimiques. Des exemples de solutions que nous pouvons trouver tous les jours sont une solution d'alcool à 75 % et une solution d'acide acétique à 24 %. Le pourcentage de masse est le nombre de grammes de soluté dans 100 grammes de masse de solution. L'équation qui montre le calcul du pourcentage de masse est la suivante :

Relation Molalité Avec Molarité
La molarité exprime le nombre de moles de soluté dans un litre de solution. La molarité peut être convertie en molalité en convertissant le volume de la solution en masse de la solution. La conversion du volume en masse nécessite des données sur la densité de la solution (p), qui peuvent être formulées comme suit :

Fraction molaire
La fraction molaire est une mesure de la concentration d'une solution qui exprime le rapport du nombre de moles dans une partie d'une substance au nombre total de moles présentes dans les composants de la solution. La fraction molaire est divisée en 2 parties :
Fraction molaire du soluté (Xt)
La formule de la fraction molaire du soluté (Xt), à savoir :

Information:
Xt = fraction molaire du soluté
Nt = nombre de moles de soluté
Np = nombre de moles de solvant
Fraction molaire de solvant (Xp)
La formule de la fraction molaire du solvant (Xp), à savoir :

Information
Xp = fraction molaire de solvant
Nt = nombre de moles de soluté
Np = nombre de moles de solvant
La somme des fractions molaires du soluté et du solvant est 1
Xt + Xp = 1
Exemples de problèmes de molalité et de solutions
Problème 1
Quelle est la molalité d'une solution contenant 4 g de NaOH (Ar Na = 23 g/mol, Ar O = 16 g/mol et Ar H = 1 g/mol) dissous dans 250 g d'eau ?
Achèvement:
Est connu:
masse de NaOH = 4 gr
ArNa = 23 gr/mol
ArO = 16 g/mol
ArH = 1 gr/mol
masse d'eau = 250 gr = 0,25 kg
Question: m = ?
Répondre:
M. NaOH = 40 gr/mol
nombre de moles de NaOH = masse/Mr
nombre de moles de NaOH = 4 gr/(40 gr/mol)
nombre de moles de NaOH = 0,1 mol
m = nombre de moles/p
m = 0,1 mole / 0,25 kg
m = 0,4 m
Problème 2
Quelle est la molalité d'une solution de HCl à 37 % (p/p)? (Ar H = 1 g/mol, Ar Cl = 35,5 g/mol)
Achèvement:
Est connu:
masse de HCl = 37%
ArH = 1 g/mol
ArCl = 35,5 g/mol
Question: m = ?
Répondre:
M. HCl = 36,5 gr/mol
supposons que la masse de la solution soit de 100 grammes alors la masse de HCl est :
Masse HCl = 37% x 100 gr
masse de HCl = 37 gr
masse de solvant = masse de solution - masse de HCl
masse de solvant = 100 gr – 37 gr
masse de solvant = 63 gr = 0,063 kg
nombre de moles de HCl = masse/Mr
nombre de moles de HCl = 37 gr /(36,5 gr/mol)
nombre de moles de HCl = 1,01 moles
m = nombre de moles/masse de solvant
m = 1,01 mol/0,063 kg
m = 16,03 m
Problème 3
Déterminer la molalité de la solution préparée en dissolvant 12 grammes d'urée CO(NH2)2 dans 250 grammes d'eau.
Achèvement:
Est connu:
masse d'urée = 12 gr
Mr Urée = 60 g/mol
masse de solvant = 250 gr = 0,25 kg
Question: m = ?
Publicité
Répondre:
nombre de moles d'urée = masse/Mr
nombre de moles d'urée = 12 gr /(60 g/mol)
nombre de moles d'urée = 0,2 mole
m = nombre de moles/masse de solvant
m = 0,2 mol / 0,25 kg
m = 0,8 m
Problème 4
Quelle est la molalité d'une solution alcoolique à 23 % masse d'éthanol (Mr = 46) ?
Répondre:
Est connu:
masse d'éthanol = 23%
Mr éthanol = 46 g/mol
Question: m = ?
Achèvement:
par exemple la masse de la solution alcoolique est de 100 grammes alors la masse d'éthanol est :
masse d'éthanol = 23% x 100 gr
masse d'éthanol = 23 gr
masse de solvant = masse de solution - masse d'éthanol
masse de solvant = 100 gr – 23 gr
masse de solvant = 77 gr = 0,077 kg
nombre de moles d'éthanol = masse/Mr
nombre de moles d'éthanol = 23 gr /(46 g/mol)
nombre de moles d'éthanol = 0,5 mol
m = nombre de moles/masse de solvant
m = 0,5 mol/0,077 kg
m = 6,49 m
Problème 5
Calculer la concentration (% en masse) de glucose dans une solution de glucose 2 molal.
Achèvement:
Est connu:
m = 2 mol = 2 mol/kg = 0,002 mol/gr
Mr glucose = 180 gr/mol
Demandé: masse de glucose (%) = ?
Répondre:
moles de glucose = masse/Mr
moles de glucose = masse de glucose/(180 g/mol)
moles de glucose = masse de glucose x 0,005 mol/gr
Remplacez les moles de glucose dans l'équation suivante :
m = moles de glucose/masse de solvant
0,002= masse de glucose x 0,005/masse de solvant
o, oo2/o, oo5 = masse de glucose/masse de solvant
2/5 = masse de glucose/masse de solvant
Ainsi, le rapport massique de glucose: masse de solvant = 2: 5, tandis que le rapport massique de glucose: masse de solution = 2: 7.
Donc,
% masse de glucose = (masse de glucose/masse de solution) x100%
% en masse de glucose = (2/7) x 100%
% masse de glucose = 28,57 %
Problème 6
Quelle est la molalité d'une solution contenant 8 g de NaOH (Ar Na = 23 g/mol, Ar O = 16 g/mol et Ar H = 1 g/mol) dissous dans 250 g d'eau ?
Discussion
Est connu:
Masse de NaOH = 8 gr
ArNa = 23 gr/mol
ArO = 16 g/mol
ArH = 1 gr/mol
masse d'eau = 250 gr = 0,25 kg
Recherché: Molalité (h)…. ?
Répondre:
M. NaOH = 40 gr/mol
Le nombre de moles de NaOH = masse/Mr
Nombre de moles de NaOH = 8 gr/(40 gr/mol)
Le nombre de moles de NaOH = 0,2 mol
m = nombre de moles/p
m = 0,2 mol / 0,25 kg
m = 0,8 m
Problème 6
Déterminer la molalité de la solution préparée en dissolvant 15 grammes d'urée CO(NH2)2 dans 250 grammes d'eau.
Discussion
Est connu:
Masse d'urée = 15 gr
Mr Urée = 60 g/mol
Masse de solvant = 250 gr = 0,25 kg
Recherché: Molalité (h)…. ?
Répondre:
Nombre de moles d'urée = masse/Mr
Moles totales d'urée = 15 gr / 60 g/mol
Le nombre de moles d'urée = 0,25 mol
m = nombre de moles/masse de solvant
m = 0,25 mol / 0,25 kg
m = 1 m
Problème 7
Quelle est la molalité d'une solution de HCl à 37 % (p/p)? (Ar H = 1 g/mol, Ar Cl = 35,5 g/mol).
Discussion
Est connu:
masse de HCl = 37%
ArH = 1 g/mol
ArCl = 35,5 g/mol
Recherché: Molalité (h)… ?
Répondre:
M. HCl = 36,5 gr/mol
Supposons que la masse de la solution soit de 100 grammes, alors la masse de HCl est :
Masse HCl = 37% x 100 gr
masse de HCl = 37 gr
masse de solvant = masse de solution - masse de HCl
masse de solvant = 100 gr – 37 gr
masse de solvant = 63 gr = 0,063 kg
nombre de moles de HCl = masse/Mr
nombre de moles de HCl = 37 gr /(36,5 gr/mol)
nombre de moles de HCl = 1,01 moles
m = nombre de moles/masse de solvant
m = 1,01 mol/0,063 kg
m = 16,03 m

Problème 8
Déterminer la quantité (grammes) de NaOH qui doit être dissoute dans 1 litre d'eau (eau = 1,00 g/mL) pour obtenir 0,25 m NaOH.
Discussion
Est connu:
1 L d'eau = 1000 mL = 1000 g (puisque ρ d'eau = 1,00 g/mL)
mNaOH = 0,25 m
Monsieur NaOh = 40
Question: gr… ?
Répondre:
mNaOH = gr / Mr x 1 000 / P
0,25 = gr/40 x 1 000/1 000
0,25 = g/40
g = 0,25 x 40
g = 10 grammes
Ainsi, la quantité de NaOH nécessaire est de 10 grammes.
Problème 9
Déterminer combien de ml d'eau sont nécessaires pour dissoudre 4,9 grammes de H2SO4 dont la concentration est de 0,25 M (Ar H = 1; S = 32; O =16) !
Discussion
Est connu:
mH2SO4 = 0,25
Mr H2SO4 = 98
gr = 4,9 grammes
Question :p ???
Répondre:
m = gr/Mr x 1 000/P
0,25 = 4,9/98 x 1 000/personne
p = 20 grammes (20 ml)
Ainsi, le volume d'eau est de 20 ml.
Problème 10
Quelle masse d'eau est nécessaire pour préparer une solution de 1,2 m en utilisant 0,6 mol de NaCl ?
Discussion
molalité (m) = 1,2 mm =
nP
1,2 =
0,6P
P=
0,61,2
= 0,5 kg
Donc la masse d'eau (masse de solvant) nécessaire est de 0,5 kg
Problème 11
Supposons qu'il y ait 2 moles de soluté dissous dans 1 litre de solvant, quelle est la molalité ?
Discussion
moles dissoutes (n) = 2 molm =
nP
m =
21
= 2m
Calculer la molalité de 25 grammes de KBr (Mr = 119) dissous dans 750 ml d'eau pure.
Discussion
soluté = 25 grammes
Monsieur = 119
solvant (P) = 750 mL = 750 grammes (car ρ d'eau = 1,00 g/mL) = 0,75 kgn =
substance dissouteM
n =
25119
= 0,21 mol
m =
nP
m =
0,210,75
= 0,28 m
Ainsi l'examen de À propos du knowledge.co.id à propos Exemple de problème de molalité , j'espère pouvoir ajouter à votre perspicacité et à vos connaissances. Merci de votre visite et n'oubliez pas de lire d'autres articles.
Table des matières
Recommandation:
- La cellulose est: définition, type, structure, propriétés et… La cellulose est: définition, type, structure, propriétés et fonctions - La cellulose est un composé semblable à une fibre et se trouve dans les parois cellulaires protectrices des plantes. Pour mieux comprendre, nous allons bien sûr discuter…
- √ Définition de l'expansion en longueur, formule, surface et volume de substance… Définition de la longue expansion, des formules, de la surface et du volume des solides - Dans cette discussion, nous expliquerons la longue expansion. Ce qui inclut la notion de longue expansion, les formules de longue expansion, l'aire, le volume de matière...
- Mesures: définition, conversion d'unité de longueur, comment… Échelle de mesure: définition, conversion des unités de longueur, mode d'emploi et exemples de questions - Qu'y a-t-il dans qu'entendez-vous par échelle de taille et comment l'utiliser?, cette fois-ci, le knowledge.co.id sera discuter...
- Liaisons covalentes: définition, caractéristiques, types, formules… Liaisons covalentes: définition, caractéristiques, types, formules chimiques et propriétés des composés - Qu'est-ce qu'une liaison covalente? A cette occasion, Seputarknowledge.co.id en discutera et bien sûr d'autres choses aussi l'a recouvert. Laisser…
- Discours environnemental: définition, objectif, caractéristiques et… Discours environnemental: définition, objectif, caractéristiques et exemples - Comment le texte du discours environnemental est-il structuré? qu'est-ce qui est bon et juste?, A cette occasion, Seputarknowledge.co.id en discutera et bien sûr des choses Lequel…
- Formules de cône, caractéristiques, propriétés, éléments et exemples de problèmes Formules de cône, caractéristiques, propriétés, éléments et exemples Problème - Comment calculer l'aire et le volume d'une forme cone space?, A cette occasion, Seputarknowledge.co.id en discutera et bien sûr d'autres choses Lequel…
- Formule de viscosité: définition de la viscosité, coefficient et… Formule de viscosité: Définition de la viscosité, coefficient et facteurs d'influence - Comment est la formule de viscosité La viscosité est une mesure de la résistance d'un fluide qui est modifiée soit par une contrainte, soit par pression. A cette occasion, Seputarknowledge.co.id…
- Unité de poids: définition, échelle de conversion et exemples… Unité de poids: définition, échelle de conversion et exemple de problème - Qu'est-ce qu'une unité de poids?, à cette occasion À propos de la connaissance.co.id en discutera, y compris la compréhension et bien sûr d'autres choses aussi l'a recouvert. Laisser…
- Moment d'inertie: définition, facteurs, équations de formes… Moment d'inertie: définition, facteurs, équations sous forme d'objets et exemples de problèmes – Ce que cela signifie avec le Moment d'Inertie?, A cette occasion, Se concernant le knowledge.co.id en discutera et bien sûr sur matière…
- Mouvement circulaire changeant uniformément: définition, amplitude… Mouvement circulaire changeant uniformément: définition, grandeur physique, formules et exemples de problèmes - Qu'est-ce que le mouvement? Changements circulaires réguliers et exemples? À cette occasion, Seputarknowledge.co.id en discutera et bien sûr sur...
- Intégrale indéfinie: définition, formules, propriétés et exemples… Intégrale indéfinie: définition, formules, propriétés et exemples de problèmes - Qu'entend-on par intégrale indéfinie? Bien sûr et comment calculer les opérations mathématiques? volonté…
- Définition des méthodes d'apprentissage: caractéristiques, objectifs, types et… Définition des méthodes d'apprentissage: caractéristiques, objectifs, types et discussion - Qu'entend-on par méthode? Apprendre?, A cette occasion, Seputarknowledge.co.id en parlera et bien sûr d'autres choses Aussi…
- Équilibre Chimique: Définition, Lois, Formules, Exemples de Problèmes Équilibre chimique: définition, lois, formules, exemples de problèmes - Dans cette discussion, nous expliquerons sur l'équilibre chimique, la loi de formule et équipé d'exemples d'équilibre chimique avec des...
- Solutions acido-basiques: définition, théorie acido-basique, propriétés et… Solutions acide-base: définition, théorie acide-base, propriétés et types - Les solutions acides et basiques sont deux groupes de composés chimiques largement répandus et utilisés dans la vie quotidienne.
- Build Space - Définition, formules et divers… Construire l'espace - Définition, formules et ses différents types - À cette occasion, nous aimerions passer en revue le matériel mathématique sur les formes géométriques, à la fois de la compréhension et des autres. Discutons tout de suite...
- √ Indicateur acide-base: définition, types et exemples Indicateurs acido-basiques: définition, types et exemples - A cette occasion, Around Knowledge abordera les indicateurs acido-basiques. Ce qui dans cette discussion explique la signification de l'indicateur d'acide...
- Loi de Boyle: définition, formules, applications et exemples… Loi de Boyle: définition, formules, applications et exemples de problèmes - Dans cette discussion, nous expliquerons la loi de Boyle. Qui comprend la signification de la loi de Boyle, la formule de la loi de Boyle, l'application de…
- Histoires courtes de motivation: définition, conseils d'écriture et exemples Histoires courtes de motivation: définition, conseils d'écriture et exemples - Qu'est-ce qu'une histoire courte de motivation?, On A cette occasion, Seputarknowledge.co.id discutera s'il s'agit de la courte histoire de l'amitié et d'autres choses à ce sujet. Voyons…
- Définition de la pression: types de pression, formules et exemples de problèmes Définition de la pression: types de pression, formules et exemples de problèmes - Qu'est-ce que la pression? A cette occasion, autour du knowledge.co.id, nous discuterons de ce qu'est la pression et quels autres éléments sont l'a recouvert. Voyons…
- Fluides dynamiques: types, caractéristiques, équation de Bernoulli, théorèmes… Fluides dynamiques: types, propriétés, équation de Bernoulli, théorème de Toricelli, formules et exemples de problèmes - Qu'est-ce que c'est? fluides dynamiques et leurs types? à propos de…
- Densité de l'eau: définition, formules et exemples Densité de l'eau: définition, formules et exemples - Quelle est la densité de l'eau? Voyons ensemble…
- Définition de quantité, unité, mesure et exemples… Définition de la quantité, de l'unité, de la mesure et des exemples (complète) - Dans les concepts de base de la physique, nous avons sûrement été initiés à quelque chose lié à la vie quotidienne. Comme mesurer la hauteur, peser la masse, mesurer la largeur,...
- Exemples de travaux scientifiques: fonctions et règles du langage Exemples d'articles scientifiques: fonctions et règles du langage - Quels sont les exemples de bonnes et correctes formes d'écriture d'articles scientifiques? Auparavant, Seputar the knowledge.co.id a discuté du travail scientifique: définition, caractéristiques, avantages,…
- Exemples de formes plates: types, caractéristiques et formules de formes plates Exemples de formes plates: types, propriétés et formules de formes plates - Quels sont les exemples de formes plates ?
- Exemples de questions d'éducation physique pour la classe 11 (XI) SMA/MA/SMK Semestre 1 et 2 Exemples de questions d'éducation physique pour la classe 11 (XI) pour SMA / MA / SMK Semestre 1 et 2 (2019 et 2020) - À cette occasion, Seputarknowledge.co.id discutera d'exemples de questions d'éducation physique pour la classe 11 Choix multiples et essai ...
- Les précipitations sont: 12 définitions selon les experts, les types,… Les précipitations sont: 12 définitions selon les types d'experts et les facteurs - Dans cette discussion, Around Knowledge expliquera les précipitations. Les précipitations sont un événement climatique naturel,...
- √ Définition des Composés Chimiques, Caractéristiques, Types & Nomenclature… Définition des composés chimiques, caractéristiques, types, nomenclature complète - Dans cette discussion, nous expliquerons les composés chimiques. Couvre la définition, les caractéristiques, les types et la nomenclature des composés chimiques avec discussion...
- Les substances uniques sont: définition, éléments et composés Les substances uniques sont: définitions, éléments et composés - Que signifie une substance unique? Regardons la discussion ensemble...
- Plan Incliné: Définition, Formules, Avantage Mécanique Et… Plan oblique: définition, formules, avantages mécaniques et exemples de problèmes - Qu'entend-on par plan oblique et comment calculer la physique? naturellement…
- Conversion d'unité: Définition, Facteur, Longueur, Masse, Temps,… Conversion d'unité: définition, facteur, longueur, masse, temps, volume et pression - Qu'est-ce que la conversion d'unité?, A cette occasion, Seputarknowledge.co.id en discutera, y compris les facteurs, les types et bien sûr d'autres choses Lequel…
