Kvanttilukumateriaali: tyypit, esimerkkitehtävät (yhteenveto)
Ladataan...
Yksinkertaisesti selitettynä kvanttiluku on luku, joka kuvaa elektronien sijaintia ja energiatasoja tai etäisyys atomin ytimestä kerralla, orbitaalien muoto, orbitaalien suunta ja elektronien spin, jotka sisältyvät mekaaniseen atomimalliin Kvantti.
Jokaisella atomilla on kiertorata, ja atomikiertoradalla on eri energiatasot. Saman kiertoradan energiatasolla on eri energiataso, jos atomit ovat erilaisia, joten vedyn kiertoradan 1s eroaa energiatasosta heliumin 1s-kiertoradalla.
Sisällysluettelo
Kvanttilukujen määritelmä

Aaltofunktiossa tällä numerolla on erityinen merkitys kuvaamaan kvanttitilanteen tilaa. Nämä luvut voivat kuvata elektronien tilaa atomissa. Vuonna 1926 Erwin Schrodinger ehdotti kvanttimekaniikan teoriaa.
Tämä teoria selittää atomin rakenteen. Tämä kvanttimekaaninen atomimalli ilmaistaan matemaattisessa yhtälössä, nimittäin aaltoyhtälössä. Vetyatomin yhtälön ratkaiseminen tuottaa aaltofunktion tai atomiradan.
Tämä atomikiertorata kuvaa atomin elektronien kvanttimäärän tilannetta. Aaltofunktion neliö tarkoittaa, että on suuri todennäköisyys saada elektroni tietyssä tilavuudessa atomin ytimen ympärillä.
Kuten Heisenbergin epävarmuusperiaatteessa, elektronien paikkaa atomeissa ei voida määrittää. Kaikki mitä voidaan tietää, on paikka, jossa elektroni todennäköisimmin löytyy.
Kvanttilukujen tyypit
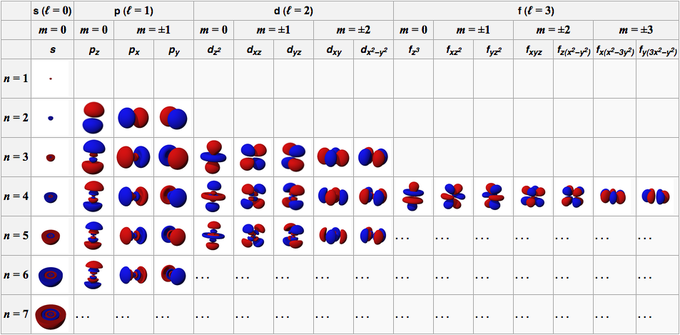
Atomin orbitaali muodostuu aaltofunktioista, jotka muodostavat kiertoradan. Yleisissä olosuhteissa atomin kiertoradan ominaisuuksia kuvataan neljällä numerolla, nimittäin n, l, m ja s.
1. Pääkvanttiluku (n)
Tämä luku koostuu positiivisista kokonaisluvuista alkaen 1 (yksi), jolloin n: n arvo on 1, 2, 3, 4, 5 ja niin edelleen. Tämä numero viittaa kuoreen, jonka atomin kiertoradalla on käytössä.
2. Atsimuuttikvanttiluku (l)
Tämä luku koostuu positiivisista kokonaisluvuista, jotka alkavat 0:sta (nolla), jolloin l: n arvo on 0, 1, 2, 3, 4, 5 ja niin edelleen. Näillä numeroilla on oma merkkinsä; 0 on s-orbitaali, 1 on p-orbitaali, 2 on d-orbitaali ja 3 on f-orbitaali.
3. Magneettinen kvanttiluku (m)
Tämä luku koostuu kokonaisluvuista, jotka alkavat 0 (nolla) - +/- 1, joten kunkin kiertoradan numeroarvo ei ole sama. S-orbitaalille m on 0, koska se on s-orbitaalissa, silloin l on 0. Kuitenkin d-orbitaaleille, joissa l on 2, m on -2, -1, 0, 1 ja 2.
4. Pyörimiskvanttinumero(t)
Jos edellinen numero ilmaisee orbitaalien suunnan, tämä numero kuvaa elektronin spiniä, jonka arvot ovat 1/2 ja -1/2.
Lukea: Kvanttimekaniikka
Orbitaalit ja kvanttiluvut
Jokaisella atomiradalla on ainutlaatuinen kolmen kvanttiluvun joukko. Nämä luvut ovat pääkvanttiluku (n), atsimuutti tai kulmamomentti (l) ja magneettinen (m). Nämä kolme numeroa kuvaavat useita asioita.
Näitä ovat kiertoradan energiatason, koon, muodon ja atomikiertoratojen mahdollisen säteittäisen jakauman suunnan kuvaaminen. Sitten on spin-luku (s), luku, joka kertoo elektronin spinin kiertoradalla.
Atomiradan muoto
Atomiradan muotoja on neljä niiden atsimuuttilukuarvojen perusteella. Neljä kiertoradan muotoa ovat seuraavat.
1. s kiertoradat
S-orbitaali on orbitaali, jonka l = 0. Se on muodoltaan pallomainen, ja sen ydin on keskellä. Koska pallolla on vain yksi suunta, kaikilla S-orbitaaleilla on vain yksi arvo m, eli m = 0. 1s-kiertoradalla on korkein elektronitiheys tai -tiheys atomiytimessä.

Atomitiheys pienenee sitten hitaasti, kun se siirtyy pois atomin ytimestä. 2s-kiertoradalla on kaksi korkean elektronitiheyden aluetta. Näiltä kahdelta alueelta on pallomainen solmu, jossa todennäköisyys kohdata elektroneja tällä alueella pienenee nollaan.
Kasvavien s-kiertoradan kärkien malli jatkuu 4s: llä, 5s: llä ja niin edelleen.
2. p. kiertoradat
P-orbitaali on orbitaali, jonka l = 1. Muoto on kuin kierretty ilmapallo, joka on varustettu kahdella lohkolla. Loikot ovat atomiytimen vastakkaisilla puolilla. Atomiydin on p-orbitaalisolmun tasolla, kahden suuren elektronitiheyden omaavan keilan välissä.

P-orbitaalilla on kolme tyyppistä avaruudellista suuntausta, nimittäin Px, Py ja Pz, joten m: llä on kolme mahdollista arvoa, nimittäin -1, 0 tai +1. Kolme orbitaalia sijaitsevat kohtisuorassa toisiinsa nähden x-, y- ja z-akseleilla suorakulmaisissa koordinaateissa. Muoto, koko ja energia ovat samat.
3. d kiertoradalla
D-orbitaali on orbitaali, jonka l = 2. Tällä kiertoradalla on viisi eri suuntausta, mikä antaa sille viisi mahdollista m: n arvoa, nimittäin -2, -1, 0, +1 tai +2. joiden neljä d-orbitaalia ovat dxy, dxz, dyx ja d2-y2.
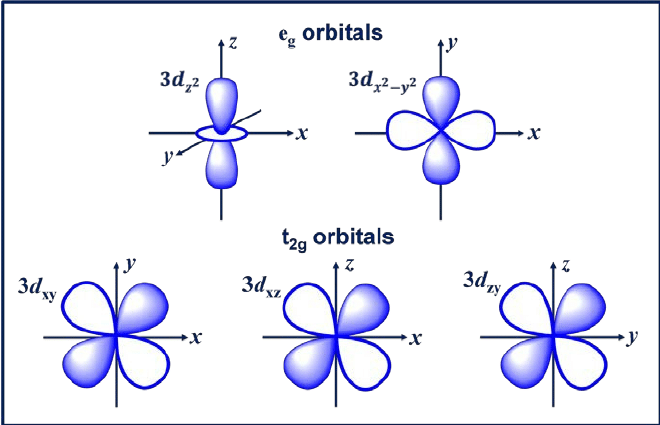
Näissä kiertoradoissa on neljä keilaa, jotka ovat apilanlehden muotoisia. Seuraava d-kiertorata on dzw, jossa on kaksi pääkeilaa z-akselilla ja yksi donitsin muotoinen osa keskellä.
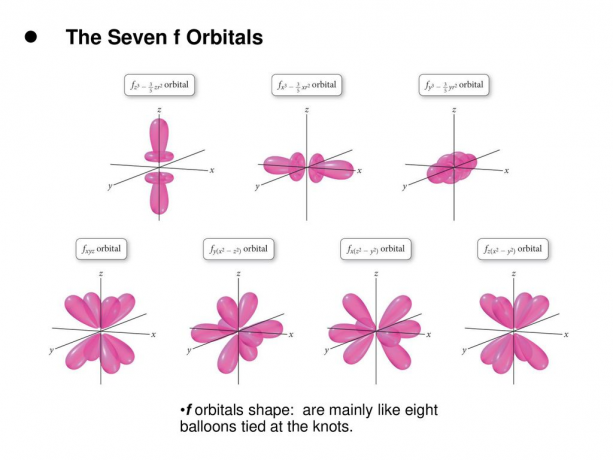
4. f. kiertoradat
F-orbitaali on orbitaali, jonka l = 3. Tällä kiertoradalla on seitsemän tyyppistä orientaatiota, samoin kuin m: llä on seitsemän mahdollista arvoa (2l + 1 = 7). Kaikilla f-orbitaaleilla on monimutkaisia muotoja, joissa on vaihteleva määrä keiloja.
Lukea: Electron Configuration
Electron Configuration
Kun ymmärrät kuinka kvanttimekaniikan atomiteoriassa on suhde atomeissa olevien elektronien ja orbitaalien välillä, Seuraavaksi opit elektronikonfiguraatiosta, elektronien järjestämisestä atomikuorten kiertoradalle monielektroni.
1. Aufbaun sääntö
Mainos
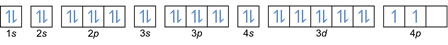
Tässä säännössä todetaan, että elektronit on täytettävä alemmalta korkeammalle energiatasolle. Orbitaalien energiatasot näkyvät atomien järjestelyssä kemiallisten elementtien jaksollisessa taulukossa.
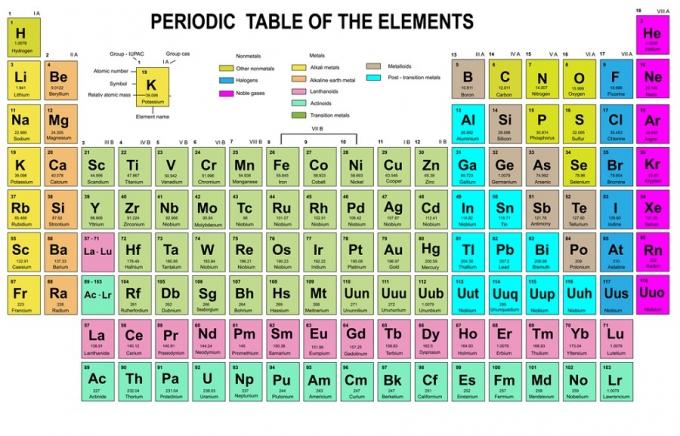
Taulukon vasempaan alakulmaan on kirjoitettu punaisella, jossa on s-lohko, sininen on lohko d, keltainen on lohko p ja vihreä on lohko f. Vaikka jokainen rivi on skin.
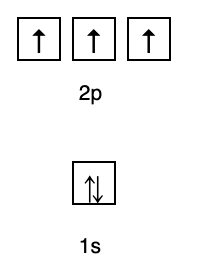
Tuon järjestelyn perusteella voit nähdä, että energiatasojen järjestys on 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p ja niin edelleen.
2. Hundin säännöt
Tämä sääntö sanoo, että jos orbitaaleja on samalla energiatasolla, elektronien on oltava täytetty rinnakkain, kunnes kaikki samalla energiatasolla olevat orbitaalit ovat täynnä elektroneja, kuten kuvassa 10 on esitetty seurata.
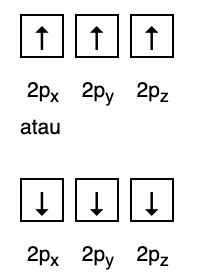
Samaan aikaan seuraava kuva ei vastaa Hundin säännön mukaista täyttöä.
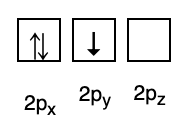
3. Paulin kielto
Paulin kielto sanoo, että elektroneilla ei voi olla samaa kvanttilukua täytettynä kiertoradalla, joten on olemassa spinluku(t), joiden arvo on +1/2. Pienin energia on se, jossa on eniten elektroneja ja rinnakkaisia spinejä.
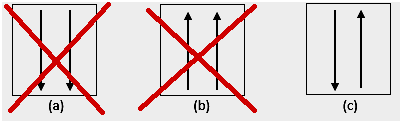
4. Anomalia

Kokeiden mukaan elektronikonfiguraatiossa on poikkeavuuksia edellä mainittujen sääntöjen mukaisesti. d-alikuori on yleensä puoliksi täynnä tai täynnä. Esimerkiksi varten 24Cr, sen elektronikonfiguraatio: [Ar] 4s1 3d5, on vakaampi kuin [Ar] 4s2 3d4.
Lisäksi elektronikonfiguraatio varten 29Cu: [Ar] 4s1 3d10, vakaampi kuin [Ar] 4s2 3d9. Samaan aikaan monoatomisten ionien, kuten K: n, elektronikonfiguraatio+, Na+, Ca2+, Br–, S2-, ja niin edelleen, voidaan määrittää ensin neutraalilla atomilla.
Positiivisesti varautuneille kationeille tai ioneille monoatomi Ax+ varauksella x+, niin niin monta kuin x elektronia poistuu neutraalin atomin A ulkoelektronikuoresta. Mitä tulee anioniin, monatomic By- y-varauksella niin monta kuin y elektronia vangitaan alhaisimman energian kiertoradalle, joka ei ole vielä täynnä.
Kuinka määrittää kvanttiluvut
Ennen kuin määrität luvun, sinun on ensin määritettävä sen elementin elektronikonfiguraatio, jolle haluat löytää kvanttiarvon. Esimerkiksi on 16S. Sen elektronikonfiguraatio on 1s2 2s2 2p6 3s2 3p4. Ota sen jälkeen viimeinen elektronikonfiguraatio, joka on 3p4.
- Tämän konfiguraation perusteella päälukuarvo on 3, koska numero 3 edustaa kiertoradan tai kuoren kokoa.
- p on elektronin alikuori, joten se voidaan saada arvon l = 1 alle.
- Koska se on p-alikuoressa, kvanttiluku on välillä -1, 0 tai +1. Kun määrität sen, piirrä ensin orbitaalilaatikko. Voit käyttää nuolia täyttäessäsi laatikkoa.
- Täytä jokainen ruutu ylöspäin osoittavalla nuolella ja täytä se sitten alas osoittavalla nuolella. Numero 4 on niiden nuolien lukumäärä, jotka on täytettävä, jotta ne saadaan näin.
↑↓ ↑ ↑
-1 0 +1
- Neljäs (viimeinen) nuoli on -1-laatikossa, jossa mekaaninen arvo on m = -1.
- Ylösnuoli on arvoltaan +1/2, kun taas alanuoli on -1/2. Viimeinen nuoli osoittaa alaspäin, joten s: n arvo = -1/2.
No, näin kvanttiluku määritetään. Tässä on joitain esimerkkejä tähän materiaaliin liittyvistä kysymyksistä tutkittavaksi.
Lukea: Fyysinen muutos
Esimerkkejä kvanttiluvuista

Tsekkaa seuraavat kysymykset!
1. Esimerkkikysymys 1
Määritä seuraavien alkuaineiden ja monoatomisten ionien elektronikonfiguraatiot ja elektronikaaviot!
- 8O2-
- 20Mg2+
- 26Fe3+
- 27Co
- 32Ge
Ratkaisu:
- Elektronikokoonpano 8O2:1s2 2s2 2p4 tai [Hän] 2s2 2p4
Elektronikokoonpano 8O2–: 1s2 2s2 2p6 tai [Hän] 2s2 2p6 tai [Ne] (plus 2 elektronia: 2s2 2p4+2)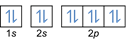
- Elektronikokoonpano 20Mg: 1s2 2s2 2p6 3s2 3p6 4s2 tai [Ar] 4s2
Elektronikokoonpano 20Mg2+: 1s2 2s2 2p6 3s2 3p6 tai [Ar] (vähennä 2 elektronia ulkokuoresta: 4s2-2)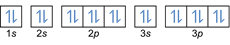
- Elektronikokoonpano 26Fe: 1s2 2s2 2p6 3s2 3p6 4s2 3d6 tai [Ar] 4s2 3d6
Elektronikokoonpano 26Fe3+: 1s2 2s2 2p6 3s2 3p6 3d5 tai [Ar]3d5 (vähennä 3 elektronia ulkokuoresta: 4s2-2 3d6-1)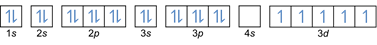
- Elektronikokoonpano 27Co: 1s2 2s2 2p6 3s2 3p6 4s2 3d7 tai [Ar] 4s2 3d7
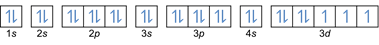
- Elektronikokoonpano 32Ge: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p2 tai [Ar] 4s2 3d10 4p2
2. Esimerkkikysymys 2
Ga: n viimeisellä elektronilla on kvanttiluku...
- n = 4; l = 0
- n = 4; l = 1
- n = 3; l = 2
- n = 4; l = 2
- n = 3; l = 1
Ratkaisu:
Jos katsot kemiallista elementtien jaksollista taulukkoa, alkuaine Ga on jaksossa IV, jolloin se on n = 4. Gallium kuuluu ryhmään 13, joten valenssielektronit ovat p-alakuoressa, mikä tarkoittaa l = 1.
3. Esimerkkikysymys 3
Alla kvanttiluku, jota Cl-atomin viimeinen elektroni ei voi miehittää, on...
- n = 3; l = 1; m = -1; s = -1/2
- n = 3; l = 1; m = 0; s =
- n = 3; l = 2; m = -1; s =
- n = 3; l = 2; m = 1; s = -1/2
- n = 3; l = 1; m = 1; s = 1/2
Ratkaisu:
Koska elementti Cl on jaksossa 3, niin n = 3. Cl on myös ryhmä 17, joten sen valenssielektronit ovat p-alakuoressa, joten l = 1. M: n arvo voi olla -1, 0 tai +1, koska kolmen kvanttiluvun energiat ovat samat ja täyttöjärjestyksellä ei ole väliä.
Sillä s voi olla myös -1/2 tai 1/2, joten emme voi määrittää m: ää ja s: tä varmasti.
4. Esimerkkikysymys 4
Elementti X3+ on sama elektronikonfiguraatio kuin elementillä Ar. Joten ioni, jolla on sama konfiguraatio kuin ionilla, on...
- K+
- Mg2+
- Na+
- Cl+
- F–
Ratkaisu:
Alkuaine Ar on jaksossa 3, joten ionilla on sama elektronikonfiguraatio kuin Ar tai [Ne] 3s2 3p6 on jaksossa 4 kationeille ja jaksolle 3 anioneille. Sopivin ioni on K+.
5. Esimerkkikysymys 5
Määritä elementin kvanttiluku 32Ge!
Ratkaisu:
Elektronikokoonpano 32Ge: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p2 tai [Ar] 4s2 3d10 4p2.
Viimeinen kokoonpano on 4p2. Energiataso on 4 ja se on p-alikuoressa, joten n = 4 ja l = 1. 4p kiertoratakaaviopiirros2 tietääksesi muut numerot seuraavasti.
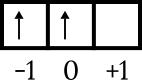
Viimeinen elektroni on laatikon kiertoradalla 0, nuoli osoittaa ylöspäin, joten m = 0 ja s = +1/2.
6. Esimerkkikysymys 6
Kaikki seuraavat ovat sallittuja kvanttilukuja, paitsi...
- n = 2; l = 1; m = -1
- n = 3; l = 2; m = 1
- n = 3; l = 3; m = -1
- n = 3; l = 0; m = 0
- n = 3; l = 2; m = -1
Ratkaisu:
Jos pääluvun (n) arvo on 3, niin suurin atsimuuttiluku (l) on n-1 = 3-1 = 2. Siksi vaihtoehdot C, joissa n = 3, l = 3 ja m = -1, eivät ole sallittuja.
Kvanttilukujen oppimiseksi sinun on myös hallittava joitakin usein käytettyjen tai ongelmissa esiintyvien elementtien atomilukuja. Lisäksi sinun tulee tuntea energiatasojen järjestely elektronikonfiguraatioita rakennettaessa.
X SULJE
Mainokset
MAINOS
X SULJE
