Boylen laki: Määritelmä, kaavat, sovellukset, esimerkkiongelmat
Boylen laki: Määritelmä, kaavat, sovellukset ja esimerkkejä ongelmista - Tässä keskustelussa selitämme Boylen lakia. Tähän sisältyy Boylen lain ymmärtäminen, Boylen lain kaava, Boylen lain soveltaminen ja esimerkkejä Boylen lain kysymyksistä, joista keskustellaan täysin ja kevyesti. Lisätietoja saat lukemalla alla olevat arvostelut huolellisesti.
Sisällysluettelo
-
Boylen laki: Määritelmä, kaavat, sovellukset ja esimerkkejä ongelmista
- Määritelmä Boylen laki
- Boylen lain kaava
- Boylen lain soveltaminen
- Boylen lakiesimerkki
- Jaa tämä:
- Aiheeseen liittyvät julkaisut:
Boylen laki: Määritelmä, kaavat, sovellukset ja esimerkkejä ongelmista
Keskustellaan ensin Boylen laista.
Määritelmä Boylen laki
Boylen laki on yksi fysiikan laeista, joka käsittelee paineen ja kaasun tilavuuden suhdetta. Robert Boyle on Boylen lain löytäjä vuonna (1627-1691), hän suoritti tutkimuksen paineen ja kaasumäärän suhteen suhteen vakiolämpötilassa. Tutkimuksestaan Robert Boyle havaitsi, että suljetussa tilassa olevan kaasun paineen ja tilavuuden tulo on vakio.
Wikipedian mukaan toinen Boylen lain määritelmä on yksi monista kemian laeista ja erityistapaus ihanteellisesta kemikaalilakista. Jos lämpötila pysyy vakiona suljetussa järjestelmässä, Boylen laki kuvaa käänteisen suhteen absoluuttisen paineen ja ilman tilavuuden välillä.
Robert Boylen löytämä Boylen laki tutkii paineen vaikutusta kaasun tilavuuteen vakiolämpötilassa. Tätä Robert Boylen lausuntoa kutsutaan Boylen laiksi, ja se kuuluu:
"Kiinteässä lämpötilassa kaasun paine suljetussa tilassa on kääntäen verrannollinen sen tilavuuteen."
Jokapäiväisessä elämässä kohtaamme usein esimerkkejä työkaluista, jotka toimivat Boylen lain mukaan, mukaan lukien polkupyörän pumput, ruiskut ja niin edelleen.

Boylen lain kaava
Boylen lain mukaan tämä tarkoittaa, että suljetussa tilassa olevan kaasun paineen ja tilavuuden tulo on vakio kaasun vakiolämpötilassa.
Yllä oleva lausunto kirjoitettuna kaavaksi, nimittäin:
P.V = C
Jossa C on kiinteä luku (vakio). Jos painetta muutetaan, myös kaasun määrä muuttuu, ja yllä oleva kaava voidaan kirjoittaa seuraavasti:
P1. V1 = P2. V2
Lue myös:Hitausmomentti: Määritelmä, tekijät, yhtälöt esineiden muodossa ja esimerkkejä ongelmista
Edellytyksessä:
P1 = alkukaasupaine (atm.cm Hg, N / m2, Pa)
P2 = lopullinen kaasun paine (atm, cm Hg, N / m2, Pa)
V1 = alkuperäinen kaasutilavuus (m3, cm3)
V2 = lopullinen kaasumäärä (m3, cm3)
Boylen lakia sovelletaan vain, kun:
- Kiinteä kaasun lämpötila tai vakio
- Kaasu on suljetussa huoneessa
- Ei kemiallisia reaktioita
- Ei muutosta kaasumaisessa tilassa
Boylen lain soveltaminen
Boylen lain soveltaminen tapahtuu pumpun toimintaperiaatteella. Pumppu on laite, jota käytetään kaasun / nesteen kuljettamiseen. Tämän toimintaperiaatteen mukaan pumppu on jaettu kahteen osaan, nimittäin imupumppuun ja painepumppuun.
Hengityksen jälkeen pumpun ilman määrä kasvaa, eikä ilma pääse renkaaseen, koska ilman on päästävä kumista valmistetun venttiilin (tuuletusaukon) läpi.
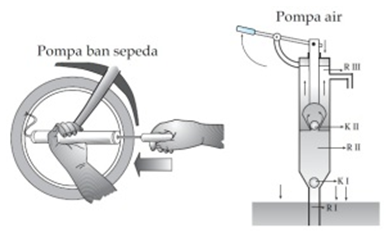
Jos tuloaukkoa painetaan, pumpun ilman määrä vähenee, ja paineen nousun vuoksi ilma pääsee renkaaseen tuuletusputken kautta. Vastaavia laitteita, jotka käyttävät Boylen lakia, ovat ruiskut, pipetit, painepumput ja vesipumput.
Boylen lakiesimerkki
Seuraavassa on esimerkkejä Boylen lakiin liittyvistä ongelmista:
1. Suljetussa kammiossa on kaasua, jonka tilavuus on 200 ml. Jos huonepaine on 60 cmHg, lasketaan sitten kaasun paine huoneessa, jonka tilavuus on 150 ml?
Ratkaisu:
Tunnetaan:
V1 = 200 ml
P1 = 60 cmHg
V2 = 150 ml
Kysyi: P2…?
Vastaus:
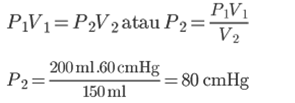
Boylen lain mukaan kaasun paine huoneessa, jonka tilavuus on 250 ml, on 80 cmHG.
2. Suljetussa tilassa, jonka tilavuus on 0,2 m3 kaasulla täytettynä, jos paine nostetaan 80 000 Pa: iin?
Ratkaisu:
Tunnetaan:
P1 = 60000 Pa
V1 = 0,2 m3
P2 = 80000 Pa Kysyttiin: V2…?
Vastaus:
P1V1=P2 V2
V2 = (P1 V1): P2
V2 = (60000 x 0,2): 80000
V2 = 1,2/8
V2 = 0,15 m3 Kaasun tilavuudesta tulee siis 0,15 M3
3. Boylen laista, s. V = k, k: lla on mitat ...
A. Teho
B. Vaivaa
C. Lineaarinen liikemäärä
D. Lämpötila
E. Jousivakio
Vastaus: B
Keskustelu:
Tunnetaan: V.p = k
Kysyi: k = …?
Vastaus:
s. V = k
k = p. V = (m³)
k = Nm = Joule
Joule on työn yksikkö. Joten k: lla on vaivannäkö.
4. Mikä seuraavista ei ole edellytys Boylen lain esiintymiselle, on ...
Lue myös:Kloonaus on: Määritelmä, tyypit, edut ja esimerkit
A. Kiinteä lämpötila
B. Kiinteä tilavuus ja paine
C. Kemiallista reaktiota ei tapahdu
D. Kaasu suljetussa tilassa
E. Kaasun tila ei muutu
Vastaus: B
Keskustelu:
Boylen lakia sovelletaan vain tietyissä olosuhteissa, kuten tasainen kaasun lämpötila, kaasu suljetussa tilassa, ei kemiallisia reaktioita eikä muutoksia kaasumaisessa tilassa.
5. Suljetussa säiliössä on kaasua, joka laajenee siten, että sen tilavuus muuttuu 2-kertaiseksi alkuperäisestä tilavuudesta (V = alkutilavuus, P = alkupaine). Kaasun paine muuttuu ...
Keskustelu
Tunnetaan :
Alkupaine (P1) = P
Alkuperäinen äänenvoimakkuus (V1) = V
Lopullinen määrä (V2) = 2V
Halusi: lopullinen paine (P2)
Vastaus:
P1 V1 = P2 V2
P V = P2 (2 V)
P = P2 (2)
P2 = P / 2 = P
Kaasun paine muuttuu alkupaineen kertaiseksi.
6. Suljetussa astiassa on kaasu, jonka paine on 2 atm ja tilavuus 1 litra. Jos kaasun paine muuttuu 4 atm: ksi, kaasun tilavuudesta tulee ...
Keskustelu
Tunnetaan :
Alkupaine (P1) = 2 atm = 2 x 105 Pascal
Lopullinen paine (P2) = 4 atm = 4 x 105 Pascal
Alkuperäinen äänenvoimakkuus (V1) = 1 litra = 1 dm3 = 1 x 10-3 m3
Etsitään: Lopullinen määrä (V2)
Vastaus:
P1 V1 = P2 V2
(2 x 105) (1 x 10-3) = (4 x 105) V2
(1) (1 x 10-3) = (2) V2
1 x 10-3 = (2) V2
V2 = x 10-3
V2 = 0,5 x 10-3 m3 = 0,5 dm3 = 0,5 litraa
7. Suljettu tila sisältää siinä kaasua, jonka tilavuus on 200 ml. Entä jos huoneen paine on 60 cmHg, joten lasketaan kaasun paine huoneessa, jonka tilavuus on 150 ml?
Ratkaisu:
Tunnetaan:
V1 = 200 ml
V2 = 150 ml
P1 = 60 cmHg
Kysyi: P2 =…?
Vastaus:
P1. V1 = P2. V2
60 cmHg. 20 ml = P2. 15 ml
P2 = 1200 cmHg / 15
P2 = 80 cmHg
Siten siitä on selitetty Boylen laki: Määritelmä, kaavat, sovellukset ja esimerkkejä ongelmista, toivottavasti voin lisätä oivallustasi ja tietämystäsi. Kiitos vierailustasi ja älä unohda lukea muita artikkeleita.
