Rutherfordin atomimääritelmä, teoria, vahvuudet ja haitat
Koulutus. Co Henkilötunnus - Tässä yhteydessä keskustelemme retherfordin atomiteoriasta, täydellinen selitys retherford-atomista kuvataan seuraavasti:
Atomin ymmärtäminen
Tämä atomi on aineen perusyksikkö, joka koostuu atomituumasta ja negatiivisesti varautuneesta elektronipilvestä, joka ympäröi sitä. Tämän atomin ydin koostuu positiivisesti varautuneista protoneista tai neutroneista, joilla on neutraali varaus.
Atomissa olevat elektronit voidaan sitoa atomituumaan sähkömagneettisten voimien avulla. Useista tällaisten atomien sarjoista voi myös liittyä toisiinsa, ja ne voivat myös muodostaa molekyylin. Atomit, jotka sisältävät saman määrän protoneja ja elektroneja, ovat neutraaleja, sitten ne, jotka sisältävät Eri lukumäärä protoneja tai elektroneja on positiivisia tai negatiivisia, ja niitä kutsutaan usein ioneiksi. Nämä atomit ryhmitellään myös atomituumassa olevien protonien ja neutronien määrän perusteella. Atomissa olevien protonien lukumäärä määrittää atomin kemiallisen elementin ja neutronien lukumäärä määrittää tietyn elementin isotoopin.
Ernerst Rutherfordin atomiteoria
Sen jälkeen kun John Daltonin atomiteoria on kumottu ja myöhemmin Jj. Thomson toteaa sen Atomi on kuin rusinaleipä, sitten on Rutherfordin vuoro kumota atomiteoria Thomsom.
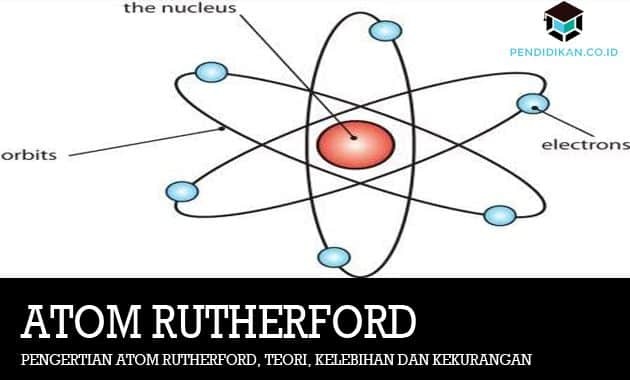
Tuolloin Rutherford sanoi, että atomilla on keskeinen ydin tai sitä kutsutaan usein ytimeksi, jota ympäröi negatiivisen varauksen omaavien elektronien pilvi.
Rutherfordin atomiteoria perustui kokeeseen, jossa pommitettiin kultalevyjen atomituumoja alfa-hiukkasilla, joka tunnetaan usein nimellä Geiger-Marsden-kokeilu. Tuossa kivessä Rutherford suunnittelee kokeellisen suunnitelman kullan atomien pommittamiseen alfahiukkasilla, jotka ovat olleet partikkeleita No, käy ilmi, on radioaktiivisia säteitä, jotka ovat heijastuneet, taipuneet tai myös toimitetaan edelleen. Sitten Rutherford selitti, että kun alfa-hiukkanen osuu atomiytimeen, tapahtuu törmäys, joka aiheuttaa alfa-hiukkasen taipuman tai heijastuksen. Tämä johtuu ytimeen keskittyvän atomin massasta ja myös varauksesta. Sitten Rutherford ehdotti, että atomiytimen varaus olisi verrannollinen atomimassaan SMA / atomimassayksiköissä. Elektronipilviin osuvia alfa-hiukkasia ei ohjata tai heijastu.
Ernerst Rutherfordutherford päätyi lopulta näiden kokeiden avulla ymmärtämiään tuloksiin ja totesi, että:
- Suurin osa atomin tilavuudesta on tyhjiö.
- Atomimassa keskittyy atomituumaan (ytimeen).
- Atomivaraus voidaan keskittää atomin keskelle melko pienellä tilavuudella. Varauskerroin on verrannollinen atomimassaan.
Lausunnollaan E. Rutherford saattoi kieltää, että atomi ei ollut kuin rusinaleipä, vaan myös kuin planeettojen järjestely kiertävän aurinkoa. Mihin aurinkoa verrataan, on positiivisesti varautunut keskusydin (ydin) tai myös planeettajärjestely, jolla on positiivinen varaus sitä kuvataan negatiiviseksi varaukseksi, joten Daltonin ja Thomsonin atomiteorialla on etuja tai haittoja, Atomiteoria E. Rutherfordilla on myös vahvuutensa ja heikkoutensa. Alla on atomiteorian E edut ja haitat. Rutherford.
Ernerst Rutherfordin atomiteorian vahvuudet ja haitat.
Ernerst Rutherfordin atomiteorian edut ja haitat ovat seuraavat:
Ernerst Rutherfordin atomiteoria
- Helppo ymmärtää pystyä selittämään hyvin monimutkainen atomirakenne
- Osaa selittää elektroniradan muodon atomiatumassa
- Osaa kuvata elektronien liikettä ytimen ympärillä
Ernerst Rutherfordin atomiteorian haitat
- Rutherfordin atomimalli ei ole pystynyt selittämään, missä elektronit sijaitsevat ja miten niitä pyöritetään näiden atomien ympäri.
- Nämä elektronit voivat päästää energiaa liikkuessaan, joten atomienergiasta tulee epävakaa.
- Ei voida selittää vetyatomin (H) viivaspektriä.
Siinä kaikki ja kiitos lukemisesta Rutherfordin atomien ymmärtämisestä, teoriasta, vahvuuksista ja heikkouksista. Toivottavasti kuvattu voi olla hyödyllistä sinulle.
Katso myösKampanjan, elementtien, tyyppien, lomakkeiden, toimintojen, tavoitteiden ja median määrittely
Katso myösHoldingyhtiön määrittely, ominaisuudet, toiminnot, edut, tavoitteet ja esimerkit
Katso myösJJ Thomsonin atomimääritelmä, teoria, vahvuudet ja haitat
