Määritelmä adsorptiosta, tyypit, tekijät, tosiasiat, erot ja esimerkit

Määritelmä adsorptio
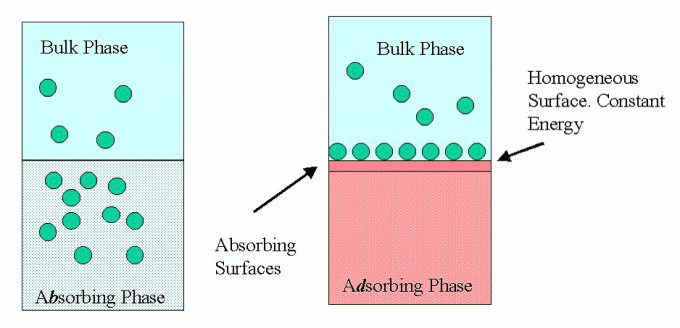
Tämän adsorption tapahtuma tai tapahtuma on tapahtuma, jossa aine houkuttelee muita läheisyydessä olevia aineita vuorovaikutukseen ja sitoutumaan aineeseen. Tämä adsorptioprosessi voi tapahtua tai voi tapahtua yhdessä faasissa olevien aineiden, kuten kiinteiden ja kiinteiden, tai eri faasien aineiden, kuten kiinteiden ja nestemäisten, välillä.
Samaan aikaan adsorption vastakohta, nimittäin desorptio, on prosessi, jolla yksi materiaali vapautetaan toisesta materiaalista.
Tämän adsorptiotapahtuman olemassaolo saa alun perin ympäristöön levinneet aineet keräämään ja sitoutumaan yhteen adsorptioväliaineeseen, jota kutsutaan nimittäin adsorbenttina, jossa tällä adsorptiomateriaalilla on kyky houkutella muita sopivia aineita vuorovaikutukseen materiaalin kanssa että. Muita adsorbenttimateriaaliin vetäviä tai myös sitoutuneita aineita kutsutaan adsorbaateiksi.
Adsorptioon liittyy vuorovaikutusta molekyylin pintojen välillä, jos adsorboivalla materiaalilla on kyseinen pinta jolla on taipumus houkutella muita materiaaleja niin, että sidottu tai sidottu adsorbaattimateriaali tarttuu pintaan adsorbentti.
Tätä adsorptioprosessia käytetään laajalti kemiallisella alalla, kuten katalysaattorina, vedenpuhdistimena ja veden pilaantumisen vähentämiseksi.
Kun puhumme adsorptiosta, tiedämme myös termin absorbointi. Pohjimmiltaan nämä kaksi tapahtumaa tai tapahtumaa ovat samanlaisia paitsi, että adsorptioon liittyy molekyylien sitoutuminen adsorbenttimateriaalin yläkerrokseen. Absorptiossa molekyylien sitoutuminen tai kiinnittyminen on yleensä syvempää niin, että ne tunkeutuvat adsorbenttimateriaalin kerrokseen. Siksi absorptiotapahtumalla on yleensä suurempi sidoslujuus.
Adsorptiotoiminnan periaate
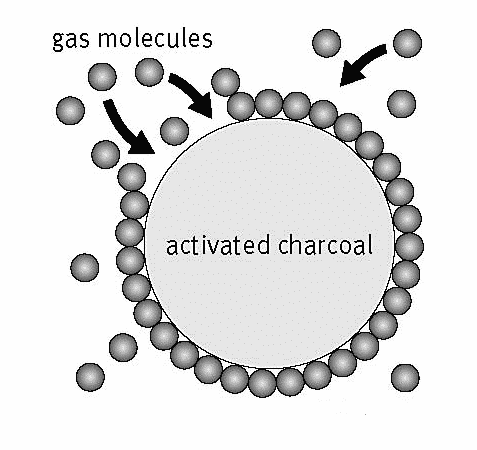
Tämä adsorptio tapahtuu epävakauden vuoksi tai myös tieteellisellä kielellä, jota kutsutaan pinnalla oleviksi jäännösvoimiksi adsorbentti, jonka stabiilisuus tekee altis sitoutumiselle muiden sopivien aineiden kanssa vakaus.
Siksi adsorboivilla materiaaleilla on yleensä ns. Ryhmiä, joilla on suuri aktiivinen kohta jolla tällä ryhmällä on tärkeä rooli adsorptioprosessissa, nimittäin vuorovaikutuksessa molekyylien kanssa adsorboida. Tämän vuorovaikutuksen lisäksi adsorptio voi johtua myös onteloiden tai huokosten läsnäolosta adsorbentissa.
Materiaalit, kuten aktiivihiili ja zeoliitti, ovat huokoisia materiaaleja, joiden pinta-ala on suuri. Tämän seurauksena adsorbaatti voi tai voi päästä huokosiin ja täyttää olemassa olevan ontelon siten, että se jää loukkuun huokosiin.
Lisäksi materiaali, joka on ollut tai on jo adsorbentissa, voidaan tai voidaan stabiloida millä tahansa tavalla erilaisia vuorovaikutuksia, kuten vetysidokset, sähköstaattiset vuorovaikutukset, dipolivuorovaikutukset, van der Waalsin vuorovaikutukset ja muut jne.
Adsorptiotyyppi

Erilaiset adsorptiotyypit ja nämä selitykset sisältävät seuraavat;
Physisorptio (fyysinen adsorptio)
Physisorptio on yksi adsorptiotyyppi, joka perustuu adsorbaatin ja adsorbentin väliseen vuorovaikutukseen. Fyysisessä adsorptiossa adsorbentti houkuttelee adsorbaattia ja molemmat kokevat fyysisiä vuorovaikutuksia, kuten houkuttelevan voiman johtuen van der Waalsin vuorovaikutuksista.
Tämä fyysinen imeytyminen ei kuitenkaan sisällä sitoutumista adsorbenttimolekyylin ja adsorbaatin välillä. Tuloksena on, että koska näiden kahden välillä ei ole sidosta, adsorbentin ja Myös adsorbaatti on yleensä heikkoa ja tämän tyyppistä adsorptiota on yleensä helpompaa esiintyä desorptio.
Kemisorptio / kemisorptio (kemiallinen adsorptio)
Kemisorptio on toinen adsorptiotyyppi, joka on adsorptio kemiallisen vuorovaikutuksen kautta. Kemisorptiossa adsorbentti- ja adsorbaattimolekyylit käyvät läpi kemiallisen sitoutumisen. Kemiallisten sidosten läsnäolo adsorbentin ja adsorbaatin välillä tekee näiden kahden aineen vuorovaikutuksesta vahvemman.
Tämän seurauksena adsorbointimolekyylien poistaminen adsorboivasta materiaalista on yleensä vaikeampi ja vaatii suurempaa energiaa kuin fysorptio. Siksi tämän tyyppistä kemisorptiota käytetään laajalti tiettyihin tarkoituksiin vahvan sidoksen luonteen vuoksi.
Fysikaalisen ja kemiallisen adsorption ero
Fysikaalisen ja kemiallisen adsorption erot (Atkin, 1999: 437-438) voidaan nähdä taulukosta, mukaan lukien seuraavat:
Fyysinen adsorptio |
Kemiallinen adsorptio |
| Van der Walls -voimat sitovat molekyylit adsorbenttiin | Nämä molekyylit ovat sitoutuneet adsorbenttiin kemiallisilla sidoksilla ikatan |
| Sen reaktioentalpia on -4, joka on -40 kJ / mol | Sen reaktioentalpia on -40 - 800 kJ / mol |
| Voi muodostaa monikerroksisia kerroksia | Muodostetaan yksikerroksinen lapisaani |
| Tämä adsorptio tapahtuu vain lämpötiloissa, jotka ovat alle adsorbaatin kiehumispisteen | Tämä adsorptio voi tapahtua tai voi tapahtua korkeissa lämpötiloissa |
| Adsorptiomäärä pinnalla on adsorbaatin funktio | Adsorptiomäärä pinnalla on adsorbentille ja adsorbaatille ominaista |
| Ei sisällä tiettyä aktivointienergiaa | Sisältää tietyn aktivointienergian |
| Se ei ole erityinen | Se on hyvin spesifinen |
Adsorptioon vaikuttavat tekijät
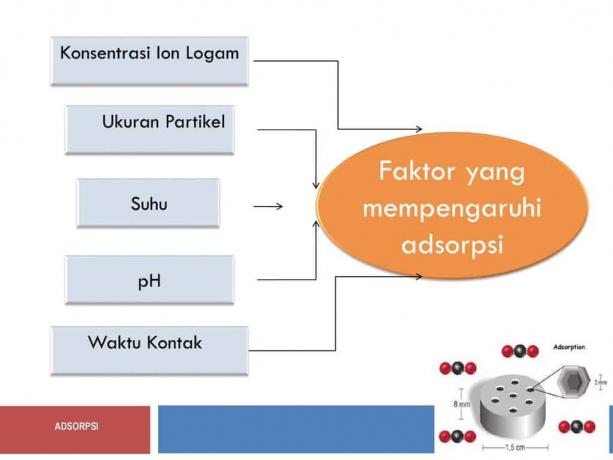
Tekijät, jotka voivat tai voivat olla liikkeellepaneva voima tälle adsorptiolle, ovat seuraavat:
Adsorbentin aktivointi
Ennen kuin materiaalia voidaan käyttää tai voidaan käyttää adsorbenttina, tämä materiaali on käsiteltävä, jota kutsutaan aktivaatioksi. Tämän aktivaatioprosessin tarkoituksena on saada adsorbenttimateriaali absorboimaan tai kykenemään absorboimaan muita aineita.
Aktivointi suoritetaan yleensä poistamalla huokosissa tai adsorbenttiontelossa oleva vieras niin adsorboiva materiaali saadaan tyhjällä ontelolla ja on myös mahdollista täyttää adsorbaatilla, joka haluttu.
Tämä aktivointiprosessi voidaan tai voidaan tehdä kaikilla tavoilla, kuten lämmittämällä höyrystämällä vierasainetta tai myös voimakkaalla happopesumenetelmällä vieraamateriaalin liuottamiseksi adsorbentti.
Adsorbentin pinta-ala
Pinta-alalla tai pinta-alalla on myös tärkeä rooli adsorptioprosessissa, koska tähän tapahtumaan liittyy adsorbentin pinta. Mitä leveämpi adsorboivan materiaalin pinta-ala on, materiaalilla on myös suurempi adsorptiokyky.
Tämä johtuu siitä, että suurempi pinta-ala osoittaa, että materiaalilla on enemmän mahdollisuuksia olla vuorovaikutuksessa adsorbaatin kanssa.
Ota yhteyttä
Pohjimmiltaan, mitä kauemmin sekoitamme adsorbenttia adsorbaatin kanssa, sitä suurempi on vuorovaikutus. Tämä johtuu siitä, että adsorptioprosessissa adsorbaatin täytyy joskus käydä läpi diffuusion, mikä myös tämä prosessi vie aikaa.
Siksi riittävän ajan kuluttua täydellinen diffuusioprosessi lisää aineen adsorptiokapasiteettia.
Lämpötilan vaikutus
Tämä ympäristön lämpötila vaikuttaa myös adsorptioprosessiin, koska periaatteessa tämä adsorptio noudattaa Le-Chatelier -periaatetta tasapainossa missä korkeampi lämpötila, adsorptioprosessi vähenee, kun taas matalissa lämpötiloissa tämä reaktio pyrkii kohti oikein.
Paineen vaikutus
Tämän paineen vaikutus esiintyy yleensä kaasumolekyylien adsorptiossa, jolloin adsorbointipaineen kasvu tässä tapauksessa on kaasua, se lisää adsorbentin adsorptiokykyä.
Tämä johtuu siitä, että korkeassa paineessa molekyyli yleensä pakotetaan viemään kapea tila, joka Tapahtuu, että molekyylit pääsevät helpommin adsorbentin onteloon tai myös huokosiin, kun painetta käytetään korkea.
Tietoja adsorptioprosessista
Kaikenlaiset faktat, jotka luonnehtivat adsorptiota tässä kemiassa, ovat seuraavat:
Adsorptio tapahtuu spontaanisti
Koska tiedämme, että kun tapahtuma tapahtuu spontaanisti, se tarkoittaa tätä tapahtumaa voi tai voi tapahtua tarvitsematta tiettyä energiaa ja voi tai voi tapahtua itse. Tämä spontaani reaktio osoittaa, että reaktiolla on negatiivinen Gibs-energia-arvo.
Adsorptiossa tämä spontaani prosessi osoittaa, että tämä adsorboiva materiaali voi tai voi absorboida adsorboitumista helposti ilman muuta energiaapua.
Adsorptio on eksoterminen prosessi
Sen lisäksi, että tämän adsorptioprosessin tapahtuu spontaanisti, sen sanotaan myös olevan eksoterminen prosessi. Lämpökemian kannalta on tutkittu tai on tutkittu, että eksoterminen prosessi osoittaa, että reaktio tapahtuu yhdessä energian vapautumisen kanssa ja tuottaa prosessissa lämpöä.
Adsorptiotapahtuma on myös sama, kun adsorbentti absorboi adsorbaattia ja muodostaa myös vuorovaikutuksen niiden välillä näiden kahden molekyylin kohdalla vapautuu tietty määrä energiaa ja saavutetaan korkeampi lämpötila kuin ympäristöön.
Esimerkki adsorptiosovelluksesta
Esimerkkejä tämän adsorption käytöstä ovat muun muassa seuraavat;
Noritin myrkkyvaimennin
Noriitti on aktiivihiilestä koostuva materiaali. Kuten tiedämme, aktiivihiili on huokoinen materiaali, jolla on erittäin hyvä adsorptiokyky. Tätä noritia käytetään adsorbenttina toksiinien, kaasujen ja aineiden imemiseen tai adsorbointiin, joita ei tarvita mahassa ja jotka sitten poistetaan.
Tawasin vedenpuhdistin
Alumiini on alumiinisulfaattimateriaali, jolla on myös suuri adsorptiokyky. Tätä alumiinimateriaalia käytetään laajalti vedenpuhdistimena, joka on tämän materiaalin vedessä on kyky absorboida muita aineita, kuten väriaineita, epäpuhtauksia ja muita epäpuhtauksia vettä.
Heavy Metal Remover
Tämä adsorptio kehitettiin myös ongelman ratkaisemiseksi teollisuusjätevesien pilaantumisongelmissa, jotka sisältävät raskasmetalleja ja jotka voivat olla vaarallisia ympäristön pilaantumisessa. Innovaatio on adsorboida raskasmetalleja veteen tehokkaalla adsorboivalla materiaalilla.
Täten selitys adsorptioiden, tyyppien, tekijöiden, tosiasioiden, erojen ja esimerkkien määritelmälle, toivottavasti kuvattu voi olla hyödyllinen sinulle. Kiitos
Katso myösMääritelmä protoneja
Katso myösMääritelmä ravitsemus
Katso myösMuiden kuin pankkilaitosten, toimintojen ja tavoitteiden määrittely
