Redoksreaktsiooni materjal: mõisted, võrdsused, näited
Laadimine...
Näited redoksreaktsioonidest, mida võime sageli kuulda, kui õppisime keskkoolis. Redoksreaktsioon on keemiline reaktsioon, mis toimub redutseerimis- ja oksüdatsioonireaktsioonide kombinatsiooni tõttu. Sellepärast muutub termin redoks (redutseerimine-oksüdatsioon)
See reaktsioon hõlmab kõiki keemilisi protsesse alates aatomitest kuni oksüdatsiooniarvu või oksüdatsiooniastme muutumiseni. Täieliku keemilise reaktsiooni korral järgneb sellele oksüdatsioonireaktsioonile alati redutseerimisreaktsioon, seega nimetatakse seda redoksreaktsiooniks.
Sisu loetelu
Redutseerimine ja oksüdatsioon

Nagu varem mainitud, on redoksreaktsioonid elektrokeemilise protsessi toimumisel tekkivate redutseerimis- ja oksüdatsioonireaktsioonide lühend.
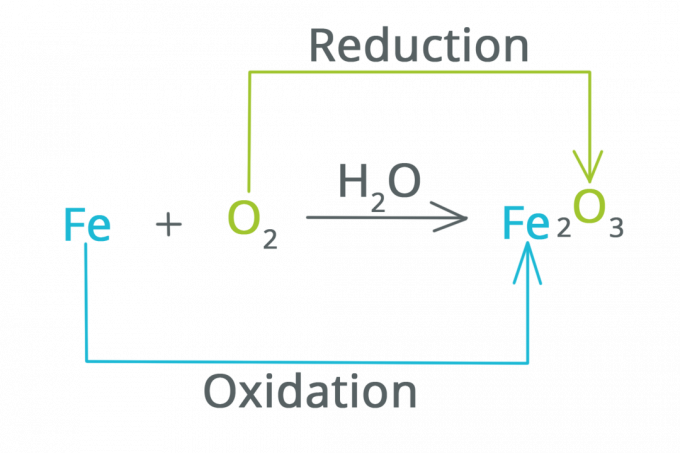
Redutseerimine on reaktsioon, mille käigus oksüdatsiooniarv väheneb ja elektronide arv suureneb. Võib öelda, et redutseerimine on reaktsioon, mis põhjustab aine hapnikukaotust.
Oksüdatsioon on reaktsioon, mille käigus oksüdatsiooniarv suureneb ja elektronide arv väheneb. Võib öelda, et oksüdatsioon on reaktsioon, mille käigus aine seondub hapnikuga.
Loe: Vedelik
Oksüdatsiooniarv (Oilox)

Redoksreaktsiooni mõiste, mis hõlmab elektronide ülekannet, võib esineda ainult ioonsetes ühendites, kovalentsete ühendite puhul aga mitte. Seetõttu tekkis kolmas redokskontseptsioon, mis põhineb oksüdatsiooniarvude muutustel.
Oksüdatsiooniarv on aatomi positiivne ja negatiivne laeng. Positiivse oksüdatsiooniastmega elemendid on üldiselt metalliliste elementidega aatomid, negatiivse oksüdatsiooniastmega elementide puhul kasutatakse tavaliselt mittemetallide aatomeid.
Oksüdatsiooninumbri muutmise kontseptsiooni alusel on selle arvu määramiseks kaheksa reeglit, nimelt:
- Aatomi- ja molekulaarse kujuga vabade elementide oksüdatsiooniarv on 0
- Ühe- ja mitmeaatomiliste ioonide oksüdatsiooniarv vastavalt iooni laengu tüübile
- Rühmade IA, IIA, IIIA elementide oksüdatsiooniarv vastavalt rühmale, kuhu need kuuluvad
- Siirderühma elementide oksüdatsiooniarv on suurem kui üks
- Iooni moodustavate elementide oksüdatsiooniarvude summa = selle laengu hulk
- Metalliga seotud vesiniku oksüdatsiooniarv = -1, samas kui H on seotud mittemetalliga, on see +1
- Hapniku arv peroksiidühendites = -1, O oksüdatsiooniarv mitteperoksiidühendites = -2
Redutseeriv ja oksüdeeriv

Enne redoksreaktsioonide näidete arutamist ei ole kunagi valus teada saada redutseerivaid aineid ja oksüdeerivaid aineid. Reaktsioonis, mis hõlmab oksüdatsioonireaktsiooni ja redutseerimist, millega kaasneb oksüdatsiooniarvu muutus.
Oksüdeerivad ained on ained, mis võivad oksüdeerida teisi aineid või aineid, mis nende reageerimisel redutseeritakse. Kuigi redutseerija on aine, mis võib redutseerida teisi aineid või aineid, mis reageerides oksüdeeruvad.
Loe: Tahke
Redoksreaktsiooni omadused
Lisaks redoksreaktsioonide näidetele peaksime teadma ka selle reaktsiooni omadusi, sealhulgas järgmisi omadusi:
- On redutseerivaid ja oksüdeerivaid aineid
- Toimub oksüdatsiooniastme muutus
- Seal on vabu elemente, nagu kloor, hapnik, vask ja teised.
Redoksreaktsiooni funktsioon

Igapäevaelus on redoksreaktsioonidel mitmesuguseid funktsioone, nimelt:
- Selleks, et mõista metalli korrosiooni protsessi ja seda, kuidas seda vältida
- Aktiivmuda kasutamine reoveepuhastusvahendina
- Taimede fotosünteesi protsess
- Toidu oksüdeerumise nägemine rakkudes
- Poldid ja mutrid on kaetud tsinkkattega, selles kihis toimub tsingi oksüdatsiooniprotsess ja katioonide redutseerimine
- Roostevabast terasest köögiriistade valmistamine, et need ei roostetaks
- Väävelhappe valmistamine ja maagi töötlemine tööstuslikeks vajadusteks.
Redoksreaktsiooni võrdsustamine

Tegelikult toimub see redoksreaktsioon vesilahustites, nii et tema võrrand hõlmab H+ ja OH-ioone. Selle õpetamiseks kasutatakse 2 meetodit, nimelt oksüdatsiooniarvude ja poolreaktsioonide abil.
Redoksreaktsioonide tasakaalustamist saab teha nii molekulaarsete kui ka ioonsete reaktsioonide oksüdatsiooniarvu või oksüdatsiooniastmete tasakaalustamisega. See oksüdatsioonimeetod põhineb põhimõttel "Kõigi e-oksüdeeritute summa võrdub e-redutseeritud koguhulgaga"
Näited redoksreaktsioonidest igapäevaelus

Redoksreaktsiooni probleemide näidetes leiame sageli küsimusi, et mainida redoksreaktsioone igapäevaelus. Järgnevalt on toodud näited igapäevaelus toimuvatest redoksreaktsioonidest, nimelt:
1. Rõivaste valgendaja
Bleach on ühend, mis võib esemetelt värvi eemaldada. Näiteks tekstiil. Valgendi põhjustatud värvikadu on tingitud oksüdatsioonireaktsioonist.
Pleegitusainetes sageli kasutatavad oksüdeerivad ained on vesinikperoksiid ja naatriumhüpoklorit.
2. Taimede fotosünteesi protsess
Fotosüntees on looduslik bioloogiline oksüdatsiooni-redutseerimisreaktsioon. Fotosüntees ise on väga keeruline protsess.
Fotosünteesiprotsessis osalevad organismid saavad kasutada päikesevalguse energiat, et toota redoksreaktsioonidest suhkrut ja hapnikku.
3. Propaani põletamine
Teine näide on põlemine. Propaani põlemisel sisaldab õhk O2, samas kui süsinikuaatomid oksüdeeruvad ja moodustavad CO2, hapnikust aga H2O.
Loe: Gaasaine
Redoksreaktsiooni probleemide näited

Reklaam
1. Määrake elemendi oksüdatsiooniaste ühendis SO42- ja NaNO3
Vastus:
NII42– = polüatomiline ioon
Mitmeaatomilise iooni Oxx = kogulaeng = -2
O oksoks ühendis = -2
Plokk S + 4. oksüdatsiooniaste = -2
-6 + 4. (-2) = -2
Niisiis, S oksüdatsiooniarv = -6 ja O oksüdatsiooniarv = -2.
NaNO3 = ühend ilma laenguta
Kogu oksüdatsiooniaste = 0
O oksoks ühendis = -2
Na (metall) Oxx = valentselektronide arv = +1
Oksüdatsiooniaste on Na + oksüdatsiooniarv on N + 3. oksüdatsiooniaste = 0
+1 + (+5) + 3. (-2) = 0
Niisiis, Na oksüdatsiooniaste = +1, oksüdatsiooniaste N = +5 ja O oksüdatsiooniaste = -2
2. Milline järgmistest on oksüdeerija, redutseerija, redutseerija ja järgmise keemilise reaktsiooni saadus.
Fe + HCl → FeCl3 + H2
Vastus:
Oksüdeeriv aine (redutseeritud) = HCl
Redutseerija (oksüdeerub) = Fe
Oksüdatsiooniprodukt = FeCl3
Vähendamise tulemus = H2
3. Tasakaalustage järgmised redoksvõrrandid
Bi2O3 + ClO– → 2BiO3– + Cl– (keele õhkkond).
Vastus:
Kuidas määrata oksüdatsiooninumbrit
Võrdsustatud vasak ja parem laeng: 2OH– + Bi2O3 + ClO– → 2BiO3– + Cl–
Sama arv aatomeid: 2OH– + Bi2O3 + 2ClO– → 2BiO3– + 2Cl– + H2O
Seega samaväärne reaktsioon: 2OH– + Bi2O3 + 2ClO– → 2BiO3– + 2Cl– + H2O
Poolreaktsiooni viis
Redoks: Bi2O3 + 2ClO– → 2BiO3– + 2Cl–
Tasakaalustage laeng, lisades OH– (alus).
2OH– + Bi2O3 + 2ClO– → 2BiO3– + 2Cl–
Tasakaalustage aatomite arv, lisades H2O.
2OH– + Bi2O3 + 2ClO– → 2BiO3– + 2Cl– + H2O
Seega samaväärne reaktsioon: 2OH– + Bi2O3 + 2ClO– → 2BiO3– + 2Cl– + H2O
Redoksreaktsioonide näidete uurimine ja isegi nende täielik käsitlemine pole lihtne, pealegi on selles materjalis nii palju ühendeid, mis tuleb meelde jätta. Seetõttu ärge kõhelge jätkamast harjutamist, et seda hästi mõista.
REKLAAM
X SULGE
