Faraday seaduse materjal: helid, valemid, näidisprobleemid
Laadimine...
Kas sa tead, mis on Faraday seadus? Üks elektromagnetismiga seotud seadustest ja ennustab elektriahelate ja magnetväljade vastastikmõjusid, et need saaksid tekitada elektromotoorjõude.
Avastas 1833. aastal Briti teadlane Michael Faraday, siiani on see kasutusel ja teatud valdkondades väga kasulik. Kas soovite teada, mida see tähendab, ja näidet küsimusest?
Sisuloend
Faraday 1. seadus

On kaks Faraday seadust, millest esimene on seotud elektrolüüsi ja elektrilaengu protsessiga.
Seal on kirjas: "Elektroodist elektrolüüsi käigus toodetud aine mass on otseselt võrdeline kasutatud elektrilaengu kogusega."
Kasutatavad võrrandid on järgmised:
W Q
W = aine mass
Q = elektronide elektrilaeng
Kasutusalad on:
Q = i x t
i = elektrivool (amprites)
t = aeg (sekundites)
Seletusega, et elektrilaengute kasutamise summa on võrdne voolutugevuse korrutisega ajas.
Lisaks on ülaltoodud seaduse kasutamise tulemustest rohkem sarnasusi, milleks on:
w I x ta
Mis puudutab selle rakenduses kasutatud valemit:
W = e.i.t/F
Teave:
W = elektrolüüsi käigus toodetud aine mass (grammides)
e = ekvivalentmass
i = voolutugevus (amprites)
t = aeg (sek)
F = Faraday määramine kindla arvuga 96 500 Coulomb/mol.
Faraday seaduse rakendamist keemiamaailmas saab näha mitmete elektrivoolu ja elektrolüüsiga seotud komponentide kaudu.
Nagu elektrigeneraatoris, mis on spetsiaalne seade, mille ülesanne on genereerida elektrienergiat mehaaniliste allikate kaudu ja kasutada elektromagnetilist induktsiooni. Generaatoreid on kahte tüüpi, nimelt vool liigub edasi-tagasi ja otse.
Järgmine rakendus on dünamo, millel on kahte tüüpi, nimelt vahelduvvool ja alalisvool.
Loe: Kirchhoffi seadus
Faraday 2. seadus

Vastupidiselt Faraday 1. seadusele on veel üks sekund kõlaga "Aine mass, mis on toodetud elektrolüüsi ajal, on otseselt proportsionaalne aine ekvivalentmassiga .
Kuigi aine massi all mõeldakse aine massi, mis on seaduse kohaldamisel. Siis on ekvivalentmass aine mass, mille moolide arv on stöhhiomeetriliselt sama kui 1 mool elektronil.
Võrrand on järgmine:
Aine mass aine massiekvivalendina
w MINA
ME = iooni/Ar oksüdatsiooniaste või laeng
Selle teise seaduse rakendamisel kasutatav valem on järgmine:
W1/W2 = e1/e2
Teave:
W1 = esimese aine mass (grammides)
W2 = teise aine mass (grammides)
e1 = esimese aine ekvivalentmass
e2 = teise aine ekvivalentmass
Selle teise seaduse rakendamisel on ekvivalentmassi funktsioon väga oluline. Jagatud oksüdatsiooniarvu muutusega, mis toimub elektrolüüsireaktsioonis.
Võrrand on järgmine:
Mtamm = Ar
Oksüdatsiooniarvu muutus
Stöhhiomeetriliste põhimõistete puhul on seos massi, mo arvu ja molaari massi vahel, mis on tihedalt seotud Faraday 1. ja 2. seaduse kombineeritud kasutamisega.
Võrrand on järgmine:
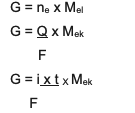
Kokkuvõte on kombineeritud võrrand numbri ja 2 vahel, nimelt:
Reklaam
G ~ i x t x Mtamm
Teave:
G = toote mass (grammides)
Q = elektrilaeng (kuloni ühikutes)
i = elektrivoolu tugevus (amprites)
t = aeg (sek)
Mtamm= aine ekvivalentmass (grammides/moolides)
F = Faraday konstant, mis on 96 500 kuloni/mol)
Loe: Hooke'i seadus
Näide Faraday seaduse probleemist
Faraday seaduse rakendamise paremaks mõistmiseks on siin mõned näited selle rakendamisest.
1. Näide 1
Elektriahelas on Cu sadestumine magnituudiga 5 grammi. Kui suur mass Ag on elektroodidele sadestunud? Lisateabe saamiseks Ag = 108 ja Cu = 63,5.
Ag või W massi leidmiseks valemAg võite kasutada järgmist valemit:
WCu = MINACu
WAg= MINAAg
ME on tuntud võrrandiga = Ar
Oksüdatsiooniarv = 2
On tuntud:
WCu = 5 grammi
Esmalt arvutage kahe aine ME, kasutades nii Cu kui ka Ag redutseerimisreaktsioone järgmiselt:
Cu2+ + 2e– → Cu(s), MEcu
= Ar = 63,5
Oksüdatsiooniarv =2
= 31,75
Ag+ + e– → Ag(s) MEAg
= Ar = 108
Oksüdatsiooniarv = 1
= 108
järgmine 5gCu = 31.75
WAg 108
= 17
Seega on settiva Ag mass = 17 grammi.
2. Näide 2
Mitu Faradayt kulub Ca ioonide redutseerimiseks?2+ kogusega 12 grammi? Siin on arutelu:
Ca2+→ valents on 2
Ca Ar on 40
Kasutatud valem on W = e x F
Kust leida F = W/e
Vastus on:
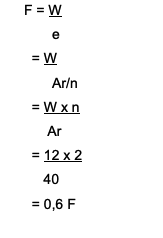
Seega kulub Ca ioonide redutseerimiseks 0,6 Faradayt2+ mis moodustab 12 grammi.
Loe: Coulombi seadus
3. Näide 3
Elektrivoolul 0,2 amprit lastakse voolata 50 minutit, seejärel siseneb see CuCl lahust sisaldavasse elektrolüüsikambrisse.2. Kui suur on katoodil tekkiva Cu sademe kogus. Lisainfona Ar alates Cu = 63,5
On tuntud:
Vool sümboliga I = 0,2 amprit
Aeg sümboliga t = 50 minutit, kui kasutada sekundites, on 50 x 60 sekundit, mis on 3000 sekundit
Küsis: WCu?
Vastus: Kõigepealt kirjutage üles Cu redutseerimisreaktsioon, nimelt:
Cu2+ (aq) + 2e+ → Cu(d)
MINACu = Ar
Oksüdatsiooniarv = 63,5/2
= 31,75
Valem, mida kasutatakse W leidmisekscu on:
Wcu = (1/96 500) x i x t x MEcu
= (1/96 500) x 0,2 A x 3000 s x 31,75
= 0,197 grammi
Seega on Cu sadestumise väärtus 0,197 grammi.
4. Näide 4
Süsinikelektroodiga elektrolüüsil suutis see tekitada Cu-tüüpi sadet koguses 12,7 grammi. Kasutab 4 amprit elektrivoolu. Kui kaua elektrolüüs aega võtab?
On tuntud:
Cu Ar = 63,5
Küsis: W?
Vastus:

Seega on elektrolüüsi aeg 9650 sekundit, kasutades kehtivat Faraday seaduse valemit.
Neile teist, kes õpivad keemiat, on muidugi vaja Faraday seadust õigesti mõista. Et seaduse kohaldamisega seotud ülesande andmisel saaksid sellele õigesti ja põhjalikult vastata, kasutades juba olemasolevaid valemeid.
X SULGE
Reklaamid
REKLAAM
X SULGE
