Puhverlahenduse materjal: põhimõtted, tüübid, näidisülesanded
Laadimine...
Üks keemias käsitletud materjale on puhverlahus, mis mängib olulist rolli pH stabiliseerimisel nii kehas kui ka teatud keemilistes reaktsioonides. Seda lahust nimetatakse ka puhver- või puhverlahuseks.
Puhverlahused lisatakse sageli igapäevaelus kasutatavatesse toodetesse. Lihtne näide on silmatilgad, mis ei tekita silma tilgutades kipitustunnet. Kuidas see juhtus? Järgnevalt on puhverlahuse üksikasjalik kirjeldus.
Sisu loetelu
Puhverlahuse määratlus

Puhverlahus on lahus, mis lisamisel pH taset üldse ei muuda hapete või alustega segamisel suurtes kontsentratsioonides madal.
Teisisõnu, sellel puhvriks kutsutud lahusel on pH-tase, mis kipub olema stabiilne, kuigi sellele on lisatud muid vedelikke. Näiteks puhver, mille pH on 5, jääb pärast veega segamist samale tasemele.
Puhver pH väärtusega 5 muutub tavaliselt tasemele 5,1 või 4,9 alles pärast väikese koguse happe või aluse lahuse lisamist. Seega ei muutu pH tasemed liiga kõrgeks või liiga madalaks.
Puhverlahuse omadused

Lihtne viis puhvrite tuvastamiseks ja eristamiseks muud tüüpi lahendustest on teada nende omadusi. Mõned puhvrite omadused hõlmavad järgmist:
- suudab säilitada esialgset pH-d hoolimata muude lahuste, näiteks vee, tugevate aluste või teatud tasemega tugevate hapete lisamisest;
- suudab säilitada algse pH-taseme isegi siis, kui lahus läbib lahjendusprotsessi;
- pH säilitamise võimsus on suurem, kui sellel on palju mooli;
- Suudab säilitada Ka väärtust nii sageli muutuval kui ka konstantsel temperatuuril.
Loe: Vedelik
Puhverlahuse põhimõte

Pange tähele, et puhvrid jagunevad kahte tüüpi, nimelt happelised ja aluselised lahused. Mida see tähendab?
- Happepuhver on teatud tüüpi lahus, mis on valmistatud nõrga happe ja selle konjugeeritud aluse segust, nii et see säilitab tõhusalt esialgse pH happelistes tingimustes;
Happepuhvri näide on CH3COOH ja CH3COO– või CH3COOH ja CH3COONa, HF ja NaF, samuti NaH2PO4 ja NaHPO4. - Aluspuhver on teatud tüüpi lahus, mis saadakse nõrgast alusest ja selle konjugeeritud happest, mis segatakse nii, et see suudab säilitada algset pH-d aluselistes tingimustes.
Aluspuhvri näide on N2H4 ja N2H5+ samuti NH3 ja NH4+.
Happed ja alused, mis on segatud nende vastavate konjugaatidega, põhjustavad vees ioonide tasakaalu. Tänu sellele suudab puhverlahus hoida pH-d kindlas vahemikus, ilma palju muutumata.
Kuidas see siis töötab? Siin on lihtne illustratsioon selgituseks:
- Kui nõrkade aluste segu (NH4OH) ja selle konjugeeritud hape lisatakse väikesele kogusele alusele, toimub reaktsioon OH-iooniga.– ja positiivsed ioonid konjugeeritud happest (NH4+);
- Kui nõrkade hapete segu (CH3COOH) ja selle konjugeeritud alus (CH3COO–) lisatakse suhteliselt väikesele kogusele happelahusele, tekib H ioonide vahel reaktsioon+ ja konjugaataluse negatiivsed ioonid (CH3COO–).
Loe: Stöhhiomeetria
Puhverlahuse funktsioon

Igapäevaelus on puhvritel inimeste ja taimede jaoks väga oluline kasutusala. Millised on kavandatud funktsioonid?
- Taimede puhul kasutatakse puhvreid pH taseme tasakaalustamiseks taimedes, mida kasvatatakse hüdropoonilise süsteemi abil. Tasakaalustatud pH-tasemed avaldavad head mõju taimede arengule;
- Inimeste jaoks mängivad puhvrid rolli vere pH muutumatuna hoidmisel. Vere pH-taset hoitakse korralikult, et ainevahetusprotsessid kehas sujuksid sujuvalt. Tüübid on hemoglobiinipuhver, fosfaatpuhver ja karbonaatpuhver;
- Inimeste jaoks on puhvritel veel üks funktsioon, nimelt püsiva pH taseme säilitamine suus, et see ei põhjustaks hammaste lagunemist. Lahus pH säilitamiseks vabaneb süljega, nii et suhu sattunud toidust saadav hape saab neutraliseerida.
Puhverlahuse maht

Tegelikult on puhverlahusel võimsus, mida tuntakse ka kui puhvri intensiivsust või puhvri indeksit. Puhvri maht on mõõt, mis näitab puhvri võimet säilitada ühtlast pH-taset, kui seda segada tugeva aluse või tugeva happega.
Puhvri intensiivsust mõjutab suuresti igas lahuses olevate aluste või hapete sisaldus. Suurima mahutavusega puhverlahus on lahus, mis sisaldab suures koguses happeid või sooli.
Näiteks CH3COOH ja CH3COONa maht oli 2 mooli suurem kui CH kombinatsioon3COOH ja CH3COONa, mis moodustab ainult 1 mool.
Samal ajal, kui sisu on väike, on ka puhvri maht väike. Kõrge tasemega puhvrindeks toimib tõhusamalt hapete või aluste neutraliseerimiseks enne olulist pH muutust.
Lisaks mõjutab puhvri mahtuvust ka happe-soola või aluse-soola moolide arvu suhe. Suur võrdlus annab muidugi puhvri, mille intensiivsus on samuti suur.
Näiteks CH3COOH ja CH3COONa, mille suhe on 1:1 (väärtus on 1), on suurem kui CH3COOH ja CH3COONa, mille suhe on 1:2 (väärtuseks saab 0,5).
Loe: Tiheduse valem
Puhverlahuse valem

Reklaam
Kuidas puhvreid arvutatakse? Nende arvutuste tegemiseks tuleb rakendada valem. Valem jaguneb kaheks, nimelt spetsiaalseks happepuhvriks ja leeliseliseks puhvriks.
Esiteks on happepuhverlahuse valem järgmine:

Ka viitab happelise tasakaalu konstandile
V on valents, mis on nõrga konjugaadi aluse või ioonisisalduse hulk
Teiseks on leeliselise puhverlahuse valem järgmine:
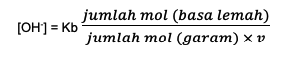
Kb on baastasakaalu konstant
V on valents, mis on konjugeeritud happe või nõrkade ioonide sisaldus
Puhverlahendusprobleemide näited ja nende arutelu

Siin on näide puhvritest arusaamise parandamiseks.
1. CH lahus3CH lahusele lisati COOH 0,1 M, Ka (10-5) kuni 200 ml.3Samuti 200 ml 0,1 M COONa, mis on siis segu pH?
Esimene samm on kõigepealt arvutada iga lahuse moolid:
mool CH3COOH = m v = 0,1 200 = 20 mmol
mool CH3COONa = m v = 0,1 200 = 20 mmol
Seejärel minge otse happepuhvri puhvervalemisse:

Nende arvutuste põhjal on H. ioonide kontsentratsioon+ see on juba teada. Järgmisena sisestage arvutus pH väärtuse leidmiseks, nimelt:
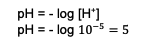
Seega on saadud segu pH 5.
2. NH lahus3 0,1 M Kb (10-5) kuni 400 ml segatuna NH lahusega4Cl 0,1 M koguni 200 ml. Määrake segu pH, mis ilmub segu tõttu!
Esimene samm on välja selgitada lahuse moolid, nimelt:
mooli NH-d3 = m v = 0,1 400 = 40 mmol
mooli NH-d4Cl = m v = 0,1 200 = 20 mmol
Pärast seda kasutage OH-ioonide kontsentratsiooni määramiseks aluspuhvri valemit– mida hiljem kasutatakse pH arvutamiseks.

Seejärel sisestage segu pH arvutamine, nimelt:
pOH = – log [OH–] = 5 – log 4
pH = 14 – pOH
pH = 14 – (5 – log 4) = 9 + log 4
Järeldus
Puhver on lahus, mis suudab pärast väikese koguse happe- või aluselahuse lisamist säilitada esialgse pH taseme teatud vahemikus. Neid on 2 tüüpi, nimelt nõrga happe ja selle soola happepuhver ning nõrgast alusest ja selle soolast valmistatud leeliseline puhver.
Oluline on õppida tundma puhverlahendusi, millel on elus funktsioon. Mitte ainult ei mõista tööpõhimõtet, vaid tean ka moodustunud puhvri segu pH-d ja happe-aluse reaktsiooni puhvri moodustamiseks.
X SULGE
Reklaamid
REKLAAM
X SULGE
