Stöhhiomeetria Keemia: mõisted, tüübid, näidisülesanded
Laadimine...
Stöhhiomeetria on keemiateadus, mis on aluseks keemilistes reaktsioonides esinevate reagentide ja saaduste kvantitatiivse suhte arvutamisel. See põhineb reaktsiooni võrrandil ja põhiseadustel.
Stöhhiomeetriliste reaktsioonide tunnuseks on see, et reagentidest või reaktsioonidest ei jää jääke, kuna need kõik on ära kasutatud. Üldiselt on seda materjali õpetatud keskkooli 10. klassis ja see tuleb sageli välja erinevatel koolieksamitel. Siin on täielik selgitus.
Sisu loetelu
Stöhhiomeetriline keemia materjal
Stöhhiomeetria õppimine tähendab, et peate mõistma mitmeid seotud asju. Mõned neist asjadest hõlmavad keemia põhiseadusi, seotud keemia mõisteid ja nende tüüpe. Vaja on ka praktilisi küsimusi, et nende arusaam oleks küpsem.
Stöhhiomeetria keemia põhiseadused
Keemias on 5 põhiseadust, mida on stöhhiomeetria mõistmiseks oluline teada, sealhulgas:
1. Massi jäävuse seadus

1789. aastal sõnastas keemik nimega Lavoisier massi jäävuse seaduse. Massi jäävuse seaduse olemus seisneb selles, et aine kogumass jääb samaks nii enne kui ka pärast keemilist reaktsiooni.
Näiteks puidu mass enne põletamist puidu põletamise tulemuse massiga ei muutu. Teisisõnu säilib aine või objekti mass, mis oli enne ja pärast reaktsiooni toimumist.
2. Fikseeritud võrdluse seadus

Joseph Proust oli ekspert, kes lõi fikseeritud proportsioonide seaduse 1799. aastal. See seadus ütleb, et konkreetse ühendi moodustavate elementide kogumassi suhe ei muutu ega püsi konstantsena.
Näitena võib tuua, et lahuses sisalduva aine A ja aine B masside suhe on alati konstantne ja seda ei mõjuta lahuse maht.
3. Mitmekordse võrdlemise seadus

Lisaks on stöhhiomeetria põhiseadus, mida tuleb mõista, mitme suhte seadus, mille koostas John Dalton 1803. aastal. Mitu võrdlust on pideva võrdluse seaduse laiendus.
Mitme proportsiooni seadus ütleb, et kui 2 elementi moodustavad rohkem kui 2 ühendit, on nende kogumass üks koostisosadest on konstantne, siis on teiste koostisosade kogukaal täisarv lihtne.
4. Gay Lussaci seadus
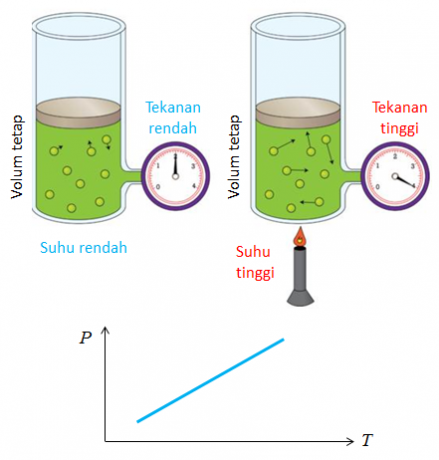
Joseph Gay Lussaci avastatud seaduse teine nimi on mahtude suhte seadus. Mahuvõrdluse seadusest tuleneb järeldus, et temperatuur ja rõhk mõjutavad gaasi mahu muutust.
5. Avogadro hüpotees
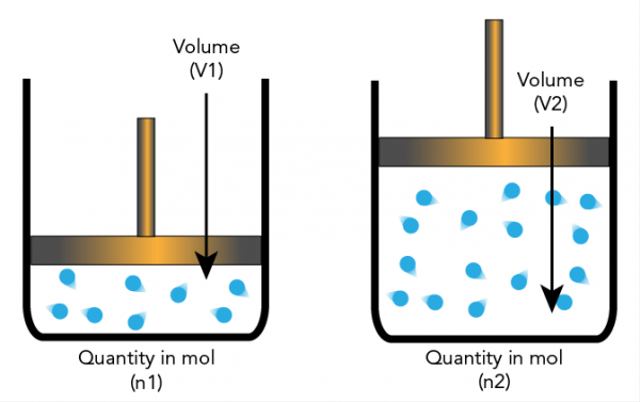
Amadeo Avogadro esitas hüpoteesi, et elementaarosakesed võivad olla molekulid ja elemendid, nii et need ei ole alati aatomid. See toob kaasa täiendavaid selgitusi, millel stöhhiomeetria põhineb.
Avogadro hüpotees väidab, et kui temperatuuril ja rõhul on sama arv, siis on sama ruumalaga gaaside vahekorras sama arv molekule.
Loe: Kolloidne materjal
Keemilised mõisted, mida stöhhiomeetrias mõista
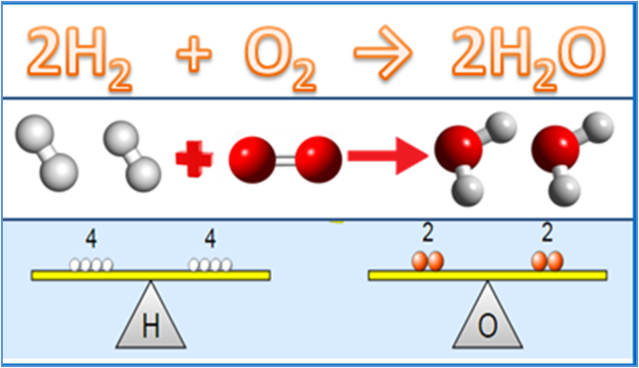
Mitte ainult põhiseadused, vaid ka muud olulised asjad, mis on stöhhiomeetrilise materjaliga tihedalt seotud, on keemia mõisted. Vähemalt on vaja mõista 4 mõistet, nimelt suhteline aatommass, suhteline molekulmass, molaarsus ja moolide mõiste.
1. Suhteline aatommass (Ar)
Keemias on suhtelise aatommassi lühend Ar. See mõiste viitab kogu aatommassile, mis määratakse kindlaks, võrreldes seda standardse aatomi kogumassiga. Rahvusvaheline Puhta ja Rakenduskeemia Liit kasutab määramisstandardina süsinikuaatomit.
Süsinikuaatom või C-12 isotoop valiti seetõttu, et sellel on stabiilne tuum, mis on inertsem kui muud tüüpi aatomid. Inertne viitab vastupidavusele toimuvatele keemilistele reaktsioonidele.
2. Suhteline molekulmass (hr)
Lisaks on olemas suhtelise molekulmassi mõiste, mida lühendatakse kui Mr. Stöhhiomeetria Mr on molekuli kogumass, mille mõõtmisel kasutatakse aatommassi ühikuid.
Reklaam
Sellest kontseptsioonist lähtuvalt on erinevatel sama ühendiga molekulidel võimalik molekulmassi erinevusi, kuna neis sisalduvad isotoobid on erinevatest elementidest.
3. Moli kontseptsioon
Keemial on arvutusprotsessi lihtsustamiseks arvestusühik, nimelt mool. Moolikontseptsioon põhineb Avogadro arvul, mis tähistab molekulide, aatomite või ioonide arvu. Selle kontseptsiooni kohaselt võrdub 1 mool 6,022 x 10-ga23 aine osakesed.
Ühe mooli massi kohta võib öelda, et see on samaväärne Ar ja Mr massiga grammides. Näiteks süsiniku molaarmass 12 g/mol on võrdne süsiniku Ar-ga 12 amu.
4. Molaarsus
Molaarsus on keemia mõiste, mis näitab lahustunud aine moolide arvu 1 liitris lahustis. Teisisõnu, molaarsus viitab kontsentratsioonile, mis on lahustunud aine kogusel ruumalaühiku kohta.
Loe: Molaarsuse valem
Keemilise stöhhiomeetria tüübid

Pange tähele, et stöhhiomeetriat on kolme tüüpi, nimelt reaktsioonid, gaasid ja ühendid või koostised. Siin on täielik selgitus:
1. Reaktsiooni stöhhiomeetria
Reaktsiooni stöhhiomeetria määratlus on teatud tüüpi mõiste, mis rõhutab konkreetses keemilises reaktsioonis esinevate ainete kvantitatiivset seost. Seda kontseptsiooni kasutatakse esinevate keemiliste võrrandite tasakaalustamiseks.
Selle selgituse põhjal võib öelda, et keemilises reaktsioonis osalevad ained mõjutavad nende ainete kvantitatiivset seost.
2. Gaasi stöhhiomeetria
Järgmisena viitab gaasistöhhiomeetria keemiliste reaktsioonide mõistele, milles esinevad gaasid. Ideaalseks gaasiks peetakse teatud rõhu, temperatuuri ja ruumalaga gaasi. Gaas koosneb ainult ühest osakeste komplektist, mille liikumine on juhuslik ega interakteeru.
Ideaalse gaasi võrrandit väljendatakse P.V = n. R.T. Valemis P on rõhk atm, V on gaasi maht liitrites, n on moolide arv, T on temperatuur 273 K ja R on gaasi 0,082 L atm/mol K.
3. Ühendstöhhiomeetria
Ühendi või koostise stöhhiomeetria definitsioon on mõiste, mis väljendab kvantitatiivset seost kogumassi või aine koguse vahel, mis konkreetse ühendi elementides on.
Seda mõistet kasutatakse sageli vesiniku ja lämmastiku kogumassi selgitamiseks, mis on ühinenud kompleksseks ammoniaagiks.
Loe: Tiheduse valem
Näiteid stöhhiomeetria probleemidest ja arutelust

Kuidas lahendada stöhhiomeetriaga seotud probleeme. Järgnev on näide küsimusest ja selle arutelust, et seda oleks lihtsam mõista:
1. Leidke iga aatomi arv, mis sisaldub 2 moolis H2O!
Tuleb märkida, et H2O-l on 2 H aatomit ja 1 O aatomit. Siis saab lahenduseks:
H aatomite arv = 2 2 mol 6,02. 1023 aatomit/mool = 24,08. 1023 aatom. Niisiis, 2 mooli H sisalduvate aatomite arv on 24,08. 1023.
Nüüd lihtsalt loendage O-aatomile kuuluvate aatomite arv, nimelt:
O-aatomite arv = 1 2 mol 6,02. 1023 aatomit/mool = 12,04. 1023 aatom. Nende arvutuste põhjal on näha, et aatomite arv 2 moolis O on 12,04. 1023.
2. Arvutage 2 mooli C kogukaal või mass6H12O6 (glükoos)! Samuti on teada, et Ar C = 12, O = 16 ja H = 1 summa.
Lahendus:
Küsimusest võib näha järgmist teavet:
n = 2 mol
hr C6H12O6 = (6 Ar C) + (12 1) + (6 16)
= 180
Järgmisena tehakse arvutus:
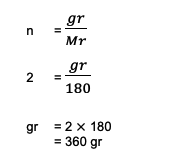
Niisiis, 2 mooli glükoosi või C kogukaal6H12O6 nende arvutuste põhjal koguni 360 grammi.
Keemias on üheks oluliseks teemaks stöhhiomeetria, mis on arvutamise põhikontseptsioon keemiliste võrrandite ja valemite kvantitatiivse seose väljaselgitamiseks. Samuti tuleb mõista mitmeid teisi keemia mõisteid, kuna need on seotud stöhhiomeetriaga.
X SULGE
Reklaamid
REKLAAM
X SULGE
