HEAT: valemid, tüübid, näidisülesanded (kokkuvõte)
Laadimine...
Soojusvalem on füüsikatundides tuttav asi. Soojus on energia vorm, mida objekt saab vastu võtta või vabastada. Kuumusel on ühikuid, mida nimetatakse džaulideks või kaloriteks.
Soojust saab tõlgendada teatud ainete soojusenergiana ja seda saab tuvastada objekti temperatuuri mõõtmise teel. Näete soojuse rakendumist avatuks jäetud soojale veele, mis järk-järgult jahtub (ei lähe enam soojaks), kuna veest eraldub soojust õhku.
Sisu loetelu
Kalorite määratlus

Soojus on energia, mis võib liikuda kõrgema temperatuuriga objektilt madalama temperatuuriga objektile, kui need kaks objekti teineteist puudutavad või kokku tuuakse. Kaks erineva temperatuuriga objekti põhjustavad soojuse voolamist ja liikumist.
Näiteks kuuma ja külma vee segamisel muutub vesi, mis seguneb, soojaks veeks. Samuti peate mõistma, et temperatuur ja kuumus on kaks erinevat asja. Temperatuur on väärtus, mida saab mõõta termomeetriga, soojus on aga energia, mis voolab.
Rahvusvahelise süsteemi (SI) ehk MKS järgi on soojusühikuks džaul (J), CGS järgi aga soojusühikuks erg. Mitme toidutüübi puhul kasutab soojus kaloriühikut.
Üks kalor on defineeritud kui soojusenergia hulk, mis on vajalik 1 grammi vee temperatuuri tõstmiseks 1 kraadini Celsiuse järgi. Seega võib järeldada, et 1 kalor = 4,184 džauli või üldiselt ümardatuna otse 4,2 J-ni.
Kalorite valem
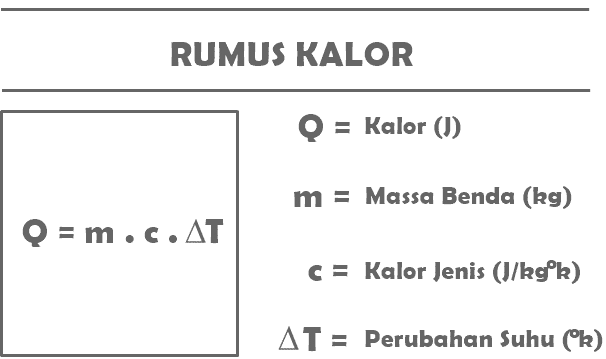
Vastavalt ülaltoodud soojuse definitsioonile on järgmised füüsikaainetes soojusmaterjalide kohta kokku võetud valemid.
1. Soojusülekande valem
Q = m. c. T
Koos:
Q = teatud objekti poolt vastuvõetud või eraldatud soojushulk (J)
m = soojust vastuvõtva või eraldava objekti mass (kg)
c = aine erisoojus (J/kg°C)
T = temperatuuri muutus (°C)
2. Spetsiifilise kuumuse valem
Selle valemi võrdlusaluseks on soojusülekande valem, eemaldades tavapäraselt matemaatiliselt arvutatava elemendi c (aine erisoojus).
c = Q/ (m. T)
Koos:
c = aine erisoojus (J/kg°C)
Q = teatud objekti poolt vastuvõetud või eraldatud soojushulk (J)
m = soojust vastuvõtva või eraldava objekti mass (kg)
T = temperatuuri muutus (°C)
3. Soojusvõimsuse valem
C = Q / T
Koos:
C = soojusmahtuvus (J/°K)
Q = palju soojust (J)
T = temperatuuri muutus (Kelvin / K)
4. Soojusvõimsuse määramise valem
C = m. c
Koos:
C = soojusmahtuvus (J/°K)
m = soojust vastuvõtva või eraldava objekti mass (kg)
c = aine erisoojus (J/kg°K)
5. Sulamissoojus ja auru valem
Sulamissoojuse valem on järgmine.
Q = m. L
Auru soojuse valem on järgmine.
Q = m. U
Koos:
Q = palju soojust (J)
m = objekti mass (kg)
L = sulamissoojus (J/kg)
U = aine aurusoojus (J/kg)
Loe: Termodünaamika
Kalorite tüübid

Konkreetses aines tööprotsessi põhjal eristatakse mitut tüüpi soojust. Allpool on toodud soojustüübid, mida peate mõistma, et näha selle igapäevaelus rakendust.
1. Moodustamissoojus (ΔHf)
Moodustamissoojus on soojus, mis tekib või on vajalik 1 mooli ühendi moodustamiseks selle elementides, näiteks gaasides, mis on kirjutatud molekulaarvalemi abil. Mõned moodustumise soojuse näited on C12, O2, Br2, H2.
2. Lagunemissoojus (ΔHd)
Lagunemissoojus on soojuse vorm, mis tekib või on vajalik 1 mooli ühendi lagundamiseks teiseks elemendiks.
3. Põlemissoojus (ΔHc)
Põlemissoojus on soojus, mis saadakse või on vajalik 1 mooli aine, näiteks elemendi või selle ühendi põletamiseks.
4. Neutraliseerimissoojus (ΔHn)
Neutraliseerimissoojus on soojuse tüüp, mis saadakse või on vajalik ühe mooli H moodustamiseks2O happe ja aluse vahelisest reaktsioonist. See kuumus on eksotermiline reaktsioon, kuna temperatuur tõuseb.
5. Lahustumissoojus (ΔHs)
Lahustumissoojus on soojuse tüüp, mis tekib või on vajalik 1 mooli algselt tahke aine lahustamiseks.
Loe: Tiheduse valem
Erisoojus ja soojusmahtuvus
Samuti peate teadma, et soojus võib voolata kahes aines, millel on erinevad aineosakesed ja erinevad temperatuurimuutused. Näiteks kui vesi ja õli kuumutada sama temperatuurini, muutub õli temperatuur rohkem kui vee temperatuur.
See võib juhtuda, kuna kahes objektis, mis on kokku pandud või kokku pandud, on erinevat tüüpi soojust. Erisoojus on soojushulk, mis on vajalik temperatuuri tõstmiseks 1 kg massilt 1 °C-ni, ühikuks on kalorid/gramm °C või J/kg °C.
Igal ainel on oma erisoojus ja selles on erinevusi. Samal ajal on soojusmahtuvuse mõiste soojushulk, mis on vajalik või neeldunud, et tõsta objekti temperatuuri 1 °C-ni.
Soojuse muutus
Selle rakenduses töötab soojusvalem põhimõttel, mis muudab kahte kokku viidud või üksteisega kokkupuutes olevat ainet. Allpool on kuumuse muutus, mis tekib siis, kui on aineid, mis on kokku pandud või kokku pandud.
1. Kuumus võib muuta aine temperatuuri
Iga põhiobjekti temperatuur on madalam kui absoluutne null, seega peab objektil olema soojust. See sisu määrab hiljem, kui palju soojust objektil on.
Kui objekt on kuumutatud, saab see lisasoojust. Samuti tõuseb või tõuseb temperatuur. Ja vastupidi, kui objekt jahutatakse, eraldub soojust ja see põhjustab temperatuuri langust.
2. Kuumus võib aineid muuta

Teatud tüüpi objektide puhul võib objekti olek muutuda, kui soojust antakse teatud ühikutes. Näiteks kui jääle antakse soojust (kuumutatakse), muutub jää kuju tahkest vedelaks või isegi gaasiliseks.
Kui kuumutamisprotsess toimub pidevalt, muudab see vee vormi tagasi aineks. See juhtub siis, kui kuju muutma hakkav objekt liigub vedeliku punktist objekti sulamispunkti.
Soojusülekande tüübid
Pärast soojuse määratluste, tüüpide, valemite ja soojuse muutuste selgitamist võite järeldada, et soojus võib liikuda ka siis, kui see kohtub või puutub kokku teiste objektidega. Järgnevalt on toodud mõned soojusülekande tüübid.
1. Juhtimine

Soojusülekanne juhtivuse teel toimub vaheaine, näiteks metalli, läbimisel, kuid sellele ei järgne aines olevate osakeste püsivat liikumist. Näiteks kui kuumutate metalli ühte otsa, läheb kuumaks ka metalli teine ots.
See on tingitud soojuse juhtivusest kõrgelt temperatuurilt madalamale temperatuurile. Kuumutatud metallotsak paneb metalliosakesed tekitama vibratsiooni teistes nendega ühendatud osakestes.
Seetõttu vibreerivad kõik metalliosakesed isegi siis, kui kuumutatakse ainult metalli ühte otsa, mis põhjustab seejärel soojusülekande. Teine näide on see, kui mootorratta väljalasketoru on mootori sisselülitamisel kuum.
Juhtivus tekib ka siis, kui hoiad tulel ilutulestikku, hoiad kinni poti kaant, mis keetmise ajal tundub kuum, või, mis kuumutamisel sulab jne. Juhtivuse soojusülekande valem on järgmine.
Soojuskiirus = Q/t = kA. T / x
2. Konvektsioon
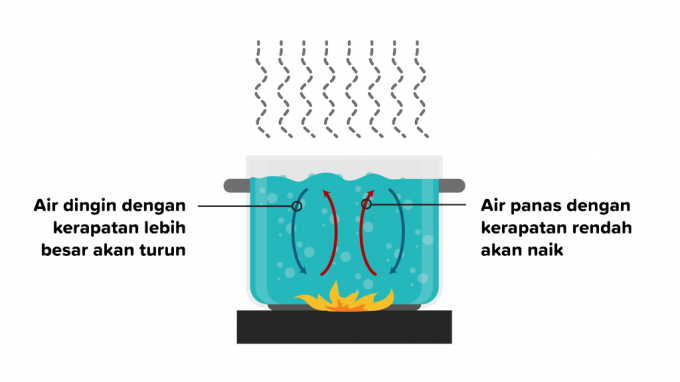
Konvektsioon on soojusülekanne, mille käigus soojus läbib ainet ja sellele järgneb aine osade liikumine. Soojusülekanne konvektsiooni teel võib toimuda vedelikes või gaasides, seega jagatakse konvektsioon kaheks järgmiselt.
a. Teaduslik konvektsioon
Konvektsioon on soojusülekanne, mis toimub ujuvuse tõttu ilma väliste teguriteta ja mida mõjutavad erinevat tüüpi objektid. Näiteks vee soojendamisel liigub kuumaveeosakeste tihedus tulest eemale, seejärel asendab selle madalama temperatuuriga vesi.
b. Sunnitud konvektsioon
Reklaam
Konvektsioon on soojusülekanne, mis on põhjustatud välistegurite, näiteks rõhu mõjul, nii et ülekanne toimub tahtlikult või sunniviisiliselt. See tähendab, et soojus on sunnitud abi tõttu kuhugi kolima.
Näited on juhtumid, kui ventilaator, mis toodab külma õhku kuumana tunduvasse kohta, mootori jahutussüsteem auto radiaatoril jne.
Teine konvektsiooni rakendus toimub vee soojendamisel, kus vesi liigub üles-alla, roheliste ubade seemned mis keetes tõuseb ja langeb, maa- ja meretuulte protsess, kuumaõhupallide liikumine, korstnasuits tehas.
Konvektsiooni teel soojusülekande valem on järgmine.
Kuumutuskiirus = Q/t = hA. T
3. Kiirgus

Kiirgus on soojuse ülekanne, mis ei vaja vaheainet ega keskkonda. Soojusülekanne kiirguses ei ole sama mis juhtivus ja konvektsioon. Kiirguse nihkumine ei vii alati kahte ainet kokku ega kohtu, sest soojus võib üle kanda ka ilma vahendajata.
See tähendab, et soojusallikas kiirgab soojust kõigis suundades, seejärel voolab see kõigis võimalikes suundades. Põhimõtteliselt võivad kõik objektid soojuskiirgust eraldada ja neelata, kuid selle hulk sõltub aine temperatuurist ja värvusest.
Mida kuumem on objekt kui temperatuur selle ümber, seda rohkem soojust see ümbritsevasse kiirgab. Seega, kui kuuma objekti pindala on suurem, on kiiratav soojus kuumem.
Näide igapäevaelus esinevatest kiirgusjuhtumitest on lõket tehes soe tunne Kuna tuleallikas on teatud kaugusel, on kiirgus tunda, kui peopesad lähendumisel soojaks lähevad tulega. Kiirguse soojusvalem on järgmine.
Soojuskiirus = Q/t = eσAT4
4. Soojuse isoleerimine

Soojusel on omadus kergesti üle kanda. Saate vältida liikumist, olgu see siis juhtivuse, konvektsiooni ja kiirguse kaudu. Näiteks ruumi isoleerides; Termos suudab hoida vee temperatuuri kuumana või soojana, nii et soojusülekannet saab vältida.
Loe: Gaasaine
Näide kaloriprobleemist

Soojusvalem on meetod, mida saate kasutada järgmiste küsimuste näidete kallal töötamiseks!
1. Näidisküsimus 1
Objekti temperatuur on 5°C ja neelab 1500 J soojust. Objekti temperatuur muutub 32°C-ni. Arvuta objekti soojusmahtuvus!
Lahendus:
Q = 1500 J
T = 32°C – 5°C = 27°C = 300°K
C = Q / T
C = 1500/300
C = 5 J/°K
2. Näidisküsimus 2
Arvutage soojust, mis kulub 5 kg vee soojendamiseks temperatuuril 25°C kuni 105°C, kui on teada, et vee erisoojus on 1000 J/kg°C!
Lahendus:
m = 5 kg
c = 1000 J/kg°C
T = 105°C – 25°C = 80°C
Q = m. c. T
Q = 5. 1000. 80
Q = 400 000 J
3. Näidisküsimus 3
Kui vee mass on 3 kg ja seda kuumutatakse 30°C kuni 100°C ja selle erisoojus on 1 J/g°C, arvuta vee jaoks vajalik soojushulk!
Lahendus:
m = 3 kg
c = 1 g/°C = 1000 J/kg°C
T = 100°C – 30°C = 70°C
Q = m. c. T
Q = 3. 1000. 70
Q = 210 000 J
4. Näidisküsimus 4
Vedeliku mass on 5 kg. Vedelik vajab soojust 200 000 J ja seda kuumutatakse 20 °C kuni 80 °C. Arvuta vedeliku erisoojus!
Lahendus:
m = 5 kg
Q = 200 000 J
T = 80°C – 20°C = 60°C
c = Q/m. T
c = 200 000 / 5. 60
c = 200 000 / 300
c = 666,67 J/kg°C
5. Näidisküsimus 5
Alumiiniumi mass on 5 kg. Algtemperatuur on 25°C. Kui alumiinium saab 250 000 J soojust ja selle erisoojus on 900 J/kg°C, arvuta alumiiniumi lõpptemperatuur!
Lahendus:
m = 5 kg
Q = 250 000 J
c = 900 J/kg°C
T1 = 25 °C
Q = m. c. T
250.000 = 5. 900. (T2 – 25)
T2 – 25 = 250.000 / 5. 900
T2 – 25 = 250.000 / 4.500
T2 – 25 = 55,56
T2 = 55,56 + 25 = 80,56 °C
6. Näidisküsimus 6
Seal on 300 grammi vett temperatuuril 25 ° C, kuumutatakse energiaga 1500 kalorit. Kui vee erisoojus on 1 cal/g°C, arvuta vee temperatuur peale selle kuumutamist!
Lahendus:
m = 300 grammi
T1 = 25 °C
c = 1 cal/g°C
Q = 1500 cal
Q = m. c. T
1.500 = 300. 1. (T2 – 25)
T2 – 25 = 1500 / 300. 1
T2 – 25 = 5
T2 = 5 + 25 = 30 °C
7. Näidisküsimus 7
Temperatuurilt 40 °C kuni 65 °C kuumutatavat vett on vaja 300 grammi. Kui vee erisoojus on 1 cal/g°C või 4200 J/kg°K, arvutage:
- Kalorites saadakse palju soojust
- Kui palju soojust võetakse vastu džaulides
Lahendus:
m = 300 g = 0,3 kg
T = 65–40 = 25 °C
c = 1 cal/g°C = 4200 J/kg°K
- Kalorid kalorites
Q = m. c. T
Q = 300. 1. 25
Q = 7500 kalorit
- Kuumus džaulides
Q = m. c. T
Q = 0,3. 4.200. 25
Q = 31 500 kalorit = 132 300 džauli
Ülaltoodud selgituse põhjal ei tiirle soojusvalem ainult vabastamise ja nõudmise ümber soojust, kuid toimub soojuse, soojusülekande, isegi iga aine erisoojuse muutus, mis varieeruda. Head harjutamist ja loodan, et see artikkel on kasulik!
X SULGE
Reklaamid
REKLAAM
X SULGE
