Kvantarvude materjal: tüübid, näidisülesanded (kokkuvõte)
Laadimine...
Lihtsalt seletades on kvantarv arv, mis kirjeldab elektronide asukohta ja energiatasemeid või kaugus aatomituumast korraga, orbitaalide kuju, orbitaalide orientatsioon ja mehaanilises aatomimudelis sisalduv elektronide spin Kvant.
Igal aatomil on orbitaal ja aatomi orbitaalidel on erinev energiatase. Sama orbitaali energiatasemel on erinev energiatase, kui aatomid on erinevad, seega erineb vesiniku 1s orbitaal energiatasemelt heeliumi 1s orbitaalist.
Sisu loetelu
Kvantarvude definitsioon

Lainefunktsioonis on sellel arvul eriline tähendus kvantolukorra oleku kirjeldamiseks. Need numbrid võivad kirjeldada elektronide olekut aatomis. 1926. aastal pakkus Erwin Schrodinger välja kvantmehaanika teooria.
See teooria selgitab aatomi struktuuri. Seda kvantmehaanilist aatomimudelit väljendatakse matemaatilises võrrandis, nimelt lainevõrrandis. Vesinikuaatomi võrrandi lahendamine annab lainefunktsiooni või aatomi orbitaali.
See aatomiorbitaal kirjeldab elektronide kvantarvu olukorda aatomis. Lainefunktsiooni ruut tähendab, et on suur tõenäosus saada elektron antud ruumis aatomituuma ümber.
Nagu Heisenbergi määramatuse põhimõtte puhul, ei saa elektronide asukohta aatomites määrata. Teada saab vaid asukohta, kus elektron kõige tõenäolisemalt leitakse.
Kvantarvude tüübid
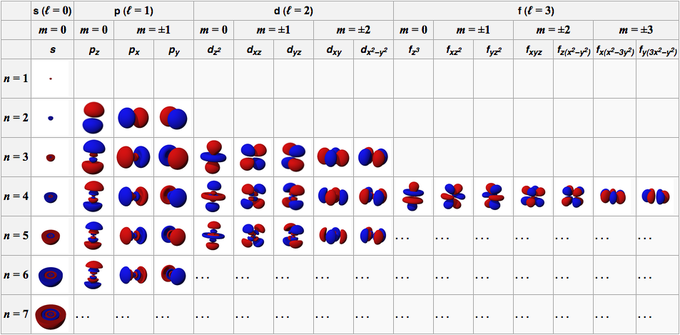
Aatomi orbitaal moodustub orbitaali moodustavatest lainefunktsioonidest. Üldtingimustes kirjeldatakse aatomi orbitaalomadusi nelja numbriga, nimelt n, l, m ja s.
1. Peamine kvantarv (n)
See arv koosneb positiivsetest täisarvudest, mis algavad 1-st (üks), mistõttu n-i väärtus on 1, 2, 3, 4, 5 jne. See arv viitab kestale, mille hõivab aatomi orbitaal.
2. Asimuudi kvantarv (l)
See arv koosneb positiivsetest täisarvudest alates 0 (null), mis teeb l väärtuseks 0, 1, 2, 3, 4, 5 jne. Nendel numbritel on oma märk; 0 on s-orbitaal, 1 on p-orbitaal, 2 on d-orbitaal ja 3 on f-orbitaal.
3. Magnetkvantarv (m)
See arv koosneb täisarvudest alates 0 (null) kuni +/- 1, seega ei ole iga orbitaali arvu väärtus sama. s-orbitaali puhul on m 0, kuna see on s-orbitaalis, siis l on 0. Kuid d-orbitaalide puhul, kus l on 2, on m -2, -1, 0, 1 ja 2.
4. Pöörlemiskvantarvud
Kui eelmine number näitab orbitaalide orientatsiooni, siis see arv kirjeldab elektroni spinni, mille väärtused on 1/2 ja -1/2.
Loe: Kvantmehaanika
Orbitaalid ja kvantarvud
Igal aatomiorbitaalil on ainulaadne kolmest kvantarvust koosnev komplekt. Need arvud on peamine kvantarv (n), asimuut või nurkimpulss (l) ja magnetiline (m). Need kolm numbrit illustreerivad mitmeid asju.
Nende hulka kuuluvad orbitaalide energiataseme, suuruse, kuju ja aatomiorbitaalide võimaliku radiaalse jaotuse orientatsiooni kirjeldamine. Seejärel on spinniarv (s), arv, mis ütleb teile elektroni spinni orbitaalil.
Aatomi orbiidi kuju
Aatomiorbitaale on neli vormi, mis põhinevad nende asimuudiarvu väärtustel. Neli orbitaalset vormi on järgmised.
1. s orbitaalid
S-orbitaal on orbitaal, mille l = 0. See on sfäärilise kujuga, mille keskel on aatomituum. Kuna keral on ainult üks orientatsioon, on kõigil S-orbitaalidel ainult üks väärtus m, st m = 0. 1s orbitaalil on suurim elektrontihedus või tihedus aatomituumas.

Aatomitihedus väheneb seejärel aeglaselt, kui see aatomituumast eemaldub. 2s orbitaalil on kaks suure elektrontihedusega piirkonda. Kahest piirkonnast on sfääriline sõlm, kus tõenäosus selles piirkonnas elektronidega kokku puutuda väheneb nullini.
Suurenevate s orbiiditippude muster jätkub 4s, 5s ja nii edasi.
2. lk orbitaalid
P-orbitaal on orbitaal, mille l = 1. Kuju on nagu keerutatud õhupall, mis on varustatud kahe labaga. Labid asuvad aatomituuma vastaskülgedel. Aatomituum on p-orbitaalsõlme tasapinnal, kahe suure elektrontihedusega sagara vahel.

P-orbitaalil on kolme tüüpi ruumiline orientatsioon, nimelt Px, Py ja Pz, seega on kolm võimalikku m väärtust, nimelt -1, 0 või +1. Kolm orbitaali paiknevad üksteisega risti x-, y- ja z-telgedel Descartes'i koordinaatides. Kuju, suurus ja energia on samad.
3. d orbitaal
D-orbitaal on orbitaal, mille l = 2. Sellel orbitaalil on viis erinevat suunda, mis annavad sellele viis võimalikku m väärtust, nimelt -2, -1, 0, +1 või +2. mille neli d-orbitaali on dxy, dxz, dyx ja d2-y2.
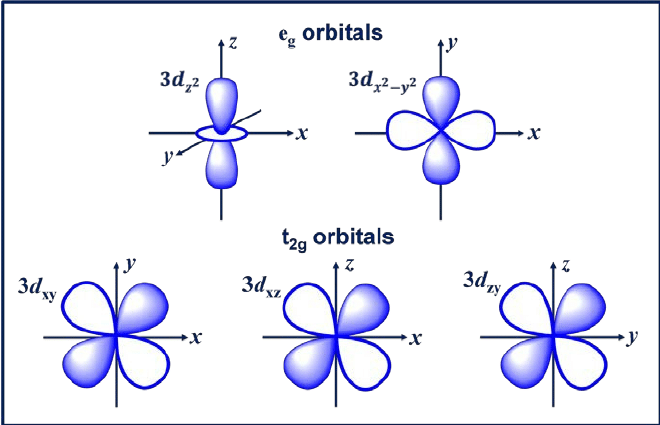
Nendel orbitaalidel on neli sagarat, mis on ristikulehe kujuga. Järgmine d-orbitaal on dzw, mille z-teljel on kaks põhisagarat ja keskel üks sõõrikukujuline osa.
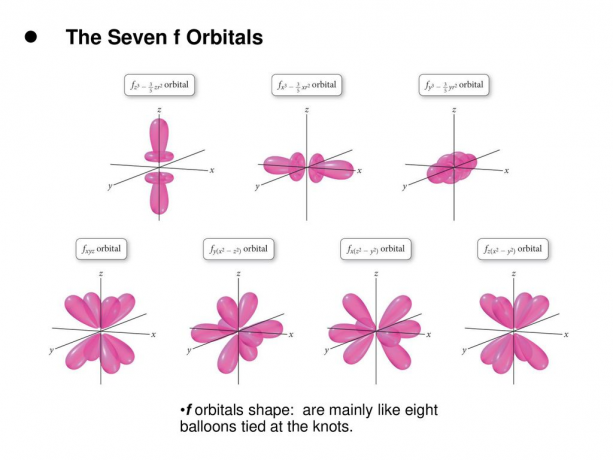
4. f. orbitaalid
F-orbitaal on orbitaal, mille l = 3. Sellel orbitaalil on seitset tüüpi orientatsiooni, nagu ka seitse võimalikku m väärtust (2l + 1 = 7). Kõik f-orbitaalid on keeruka kujuga ja erineva arvu labadega.
Loe: Elektronide konfiguratsioon
Elektronide konfiguratsioon
Kui olete aru saanud, kuidas kvantmehaanika aatomiteoorias on seos elektronide olemasolu aatomites ja orbitaalide vahel, Järgmisena saate teada elektronide konfiguratsioonist, kuidas paigutada elektrone aatomikestade orbitaalidele mitme elektroniga.
1. Aufbau reegel
Reklaam
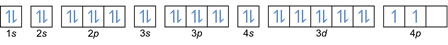
Selles reeglis on kirjas, et elektronid tuleb täita madalamalt energiatasemelt kõrgemale. Orbitaalide energiatasemeid saab näha keemiliste elementide perioodilises tabelis aatomite paigutusest.
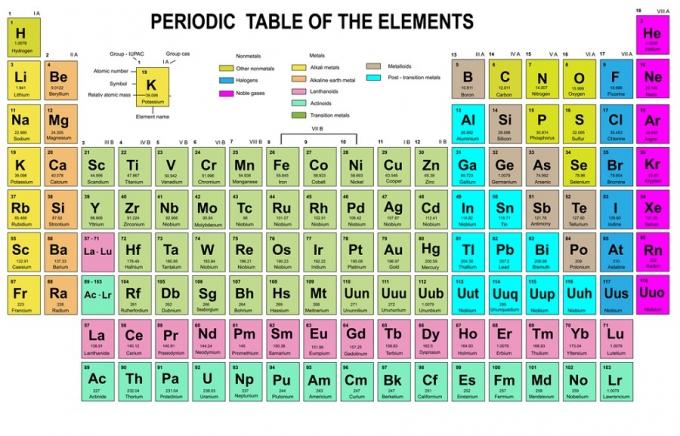
Tabelis on alumises vasakus servas punasega kirjutatud, kus on plokk s, sinine on plokk d, kollane on plokk p ja roheline on plokk f. Kuigi iga rida on nahk.
Selle paigutuse põhjal näete, et energiatasemete järjekord on 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p jne.
2. Hundi reeglid
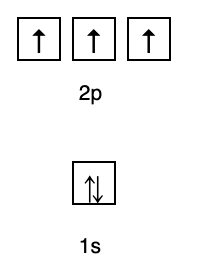
See reegel ütleb, et kui orbitaalid on samal energiatasemel, siis elektronid peavad olema täidetakse paralleelselt, kuni kõik samal energiatasemel olevad orbitaalid on täidetud elektronidega, nagu on näidatud joonisel fig järgnev.
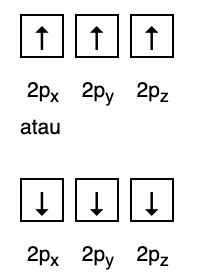
Samal ajal ei vasta järgmine joonis Hundi reegli kohasele täitmisele.
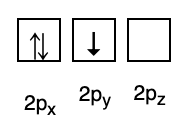
3. Pauli keeld
Pauli keeld ütleb, et elektronidel ei saa orbitaalil täidetuna olla sama kvantarv, seega on olemas spinnarv(id), mille väärtus on +1/2. Madalaim energia on see, millel on kõige rohkem paarunud elektrone ja paralleelseid spine.
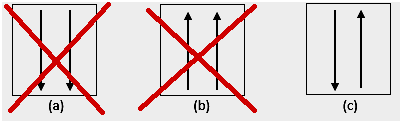
4. Anomaalia

Katsete kohaselt esineb elektronide konfiguratsioonis anomaaliaid ülalnimetatud reeglite järgi. d alamkest on tavaliselt pooltäis või täis. Näiteks selleks 24Cr, selle elektronkonfiguratsioon: [Ar] 4s1 3d5, on stabiilsem kui [Ar] 4s2 3d4.
Lisaks elektronide konfiguratsioon jaoks 29Cu: [Ar] 4s1 3d10, stabiilsem kui [Ar] 4s2 3d9. Samal ajal on monoatomiliste ioonide, näiteks K, elektronkonfiguratsioon+, Na+, Ca2+, Br–, S2-ja nii edasi saab kõigepealt määrata neutraalse aatomi järgi.
Positiivselt laetud katioonide või ioonide jaoks on monoatom Ax+ laenguga x+, siis eemaldatakse neutraalse aatomi A välisest elektronkihist tervelt x elektroni. Mis puutub aniooni, siis monatomic Bja- y-laengu korral püütakse koguni y elektroni madalaima energiaga orbitaalile, mis pole veel täis.
Kuidas määrata kvantnumbreid
Enne arvu määramist peate esmalt tegema elemendi elektronkonfiguratsiooni, mille kvantväärtust soovite leida. Näiteks on 16S. Selle elektronide konfiguratsioon on 1 s2 2s2 2p6 3s2 3p4. Pärast seda võtke viimane elektronide konfiguratsioon, mis on 3p4.
- Selle konfiguratsiooni põhjal on põhiarvu väärtus 3, kuna number 3 tähistab orbitaali või kesta suurust.
- p on elektroni alamkiht, seega saab selle saada väärtusega l = 1.
- Kuna see asub p alamkestas, jääb kvantarv -1, 0 või +1 vahele. Selle määramisel joonistage esmalt orbitaalkast. Kasti täitmisel saad kasutada nooli.
- Täitke iga kast ülespoole suunatud noolega, seejärel täitke see alla suunatud noolega. Arv 4 on noolte arv, mis tuleb täita, et saada niimoodi.
↑↓ ↑ ↑
-1 0 +1
- Neljas (viimane) nool on -1 kastis, kus mehaaniline väärtus on m = -1.
- Ülesnoole väärtus on +1/2, allapoole suunatud noole väärtus aga -1/2. Viimane nool on see, mis on suunatud alla, seega s väärtus = -1/2.
Noh, nii saab kvantarvu määrata. Siin on mõned näited selle materjaliga seotud küsimustest, mida saate uurida.
Loe: Füüsiline muutus
Kvantarvude näited

Tutvu järgmiste küsimustega!
1. Näidisküsimus 1
Määrake järgmiste elementide ja monoatomiliste ioonide elektronkonfiguratsioonid ja elektrondiagrammid!
- 8O2-
- 20Mg2+
- 26Fe3+
- 27Co
- 32Ge
Lahendus:
- Elektronide konfiguratsioon 8O2:1s2 2s2 2p4 või [Ta] 2s2 2p4
Elektronide konfiguratsioon 8O2–: 1s2 2s2 2p6 või [Ta] 2s2 2p6 või [Ne] (pluss 2 elektroni: 2s2 2p4+2)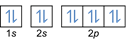
- Elektronide konfiguratsioon 20Mg: 1 s2 2s2 2p6 3s2 3p6 4s2 või [Ar] 4s2
Elektronide konfiguratsioon 20Mg2+: 1s2 2s2 2p6 3s2 3p6 või [Ar] (väliskihist lahutatakse 2 elektroni: 4 s2-2)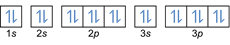
- Elektronide konfiguratsioon 26Fe: 1s2 2s2 2p6 3s2 3p6 4s2 3d6 või [Ar] 4s2 3d6
Elektronide konfiguratsioon 26Fe3+: 1s2 2s2 2p6 3s2 3p6 3d5 või [Ar]3d5 (lahutage väliskestast 3 elektroni: 4 s2-2 3d6-1)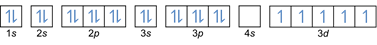
- Elektronide konfiguratsioon 27Co: 1s2 2s2 2p6 3s2 3p6 4s2 3d7 või [Ar] 4s2 3d7
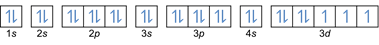
- Elektronide konfiguratsioon 32Ge: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p2 või [Ar] 4s2 3d10 4p2
2. Näidisküsimus 2
Ga viimasel elektronil on kvantarv...
- n = 4; l = 0
- n = 4; l = 1
- n = 3; l = 2
- n = 4; l = 2
- n = 3; l = 1
Lahendus:
Kui vaatate elementide keemilist perioodilist tabelit, on element Ga IV perioodis, andes sellele n = 4. Gallium kuulub rühma 13, seega on valentselektronid p alamkestas, mis tähendab l = 1.
3. Näidisküsimus 3
Allpool on kvantarv, mida ei saa hõivata Cl-aatomi viimane elektron, ...
- n = 3; l = 1; m = -1; s = -1/2
- n = 3; l = 1; m = 0; s =
- n = 3; l = 2; m = -1; s =
- n = 3; l = 2; m = 1; s = -1/2
- n = 3; l = 1; m = 1; s = 1/2
Lahendus:
Kuna element Cl on 3. perioodis, siis n = 3. Cl on samuti rühm 17, seega on selle valentselektronid p alamkestas, seega l = 1. M väärtus võib olla -1, 0 või +1, kuna kolme kvantarvu energiad on samad ja täitmise järjekord ei oma tähtsust.
Sest s võib olla ka väärtus -1/2 või 1/2, nii et me ei saa m ja s kindlalt määrata.
4. Näidisküsimus 4
Element X3+ on sama elektronkonfiguratsiooniga kui elemendil Ar. Niisiis, ioon, millel on iooniga sama konfiguratsioon, on ...
- K+
- Mg2+
- Na+
- Cl+
- F–
Lahendus:
Element Ar on perioodis 3, seega on ioonil sama elektronkonfiguratsioon kui Ar või [Ne] 3s2 3p6 on katioonide puhul 4. perioodil ja anioonide puhul 3. perioodil. Kõige sobivam ioon on K+.
5. Näidisküsimus 5
Määrake elemendi kvantarv 32Ge!
Lahendus:
Elektronide konfiguratsioon 32Ge: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p2 või [Ar] 4s2 3d10 4p2.
Viimane konfiguratsioon on 4p2. Energiatase on 4 ja on p alamkestas, seega n = 4 ja l = 1. 4p .orbitaaldiagrammi joonis2 saada teada teisi numbreid järgmiselt.
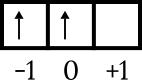
Viimane elektron on kasti orbitaalil 0, nool on suunatud üles, seega m = 0 ja s = +1/2.
6. Näidisküsimus 6
Kõik järgmised on lubatud kvantarvud, välja arvatud...
- n = 2; l = 1; m = -1
- n = 3; l = 2; m = 1
- n = 3; l = 3; m = -1
- n = 3; l = 0; m = 0
- n = 3; l = 2; m = -1
Lahendus:
Kui põhiarvu (n) väärtus on 3, siis maksimaalne asimuutarv (l) on n-1 = 3-1 = 2. Seetõttu ei ole valikud C n = 3, l = 3 ja m = -1 lubatud.
Kvantarvude õppimiseks peate valdama ka mõningaid sageli kasutatavate või probleemides esinevate elementide aatomarvusid. Lisaks peaksite elektronide konfiguratsioonide koostamisel teadma energiatasemete paigutust.
X SULGE
Reklaamid
REKLAAM
X SULGE
