Molaarsuse ja molaarsuse valemid ja näidisprobleemid
Laadimine...
Lahuse kolligatiivne iseloom on üks XI klassi SMA kemikaale. Selle materjali mõistmiseks peate hästi valdama lahuse molaarsuse ja molaalsuse valemeid, kuna see peatükk on tihedalt seotud lahuse kontsentratsiooniga.
Neile teist, kes ei tea, on lahus lahustite (tavaliselt vesi või H) homogeenne segu.2O) lahustunud ainega. Selle materjali mõistmise hõlbustamiseks esitame siin selle mõistmisest kuni lahuse molaarsuse ja molaarsuse küsimuste näideteni.
Sisuloend
Molaarsuse mõistmine

Molaarsus on lahustuvuse mõõt, mis väljendab lahustunud aine moolide arvu lahuse ruumala kohta. Molaarsuse sümboliks on tähis M (suur), mille molaarühikud on ekvivalentsed moolidega liitri kohta.
Loe: Happeline alus
Molaarsuse valem

Kui varem oli arusaam molaarsusest, siis kuidas on valemiga? Noh, siin on molaarsuse valem:
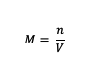
M = aine molaarsus (molaarne või mol/l)
n = aine moolid (moolid)
V = lahuse maht (ml)
Lisaks ülaltoodud valemile saate molaarsuse arvutada ka järgmise valemi abil:
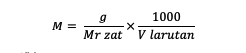
M = aine molaarsus (molaarne või mol/l)
g = aine mass (grammides)
Mr = aine suhteline molekulmass (grammi/mooli kohta)
V = lahuse maht (ml)
Kui lahus on segatud, kehtib valem:
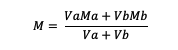
Va = aine maht a
Vb = aine maht b
Ma = aine molaarsus a
Mb = aine b molaarsus
Kui lahus on lahjendatud, on kasutatav molaarsusvalem järgmine:
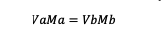
Va = aine maht a
Vb = aine maht b
Ma = aine molaarsus a
Mb = aine b molaarsus
Mooli väärtuse saamiseks peate selle arvutama järgmise valemi abil:
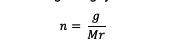
n = aine moolid (moolid)
g = aine mass (grammides)
Mr = aine suhteline molekul (grammi/mooli kohta)
Molaalsuse määratlus

Esmapilgul sarnane, kuid erinev molaarsus sa tead molaalsusega!
Molaalsus ehk molaalne kontsentratsioon on lahustunud aine moolide arv ühe kilogrammi lahusti kohta. Definitsiooni järgi on molaalsus suurus, mis näitab lahustunud aine moolide arvu lahusti massiühiku kohta. Molaalsust tähistatakse tähisega m (väike).
Loe: Ohmi seadus
Molaalsuse valem

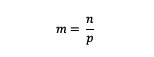
m = aine molaalsus (molaalsus)
n = aine moolid (moolid)
p = lahusti mass (grammides)
Lisaks saate molaalsuse arvutada ka järgmise valemi abil:
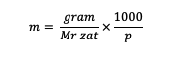
m = aine molaalsus (molaalsus)
Mr = aine suhteline molekul (grammi/mooli kohta)
p = lahusti mass (grammides)
Molaarsuse ja molaarsuse valemite erinevus
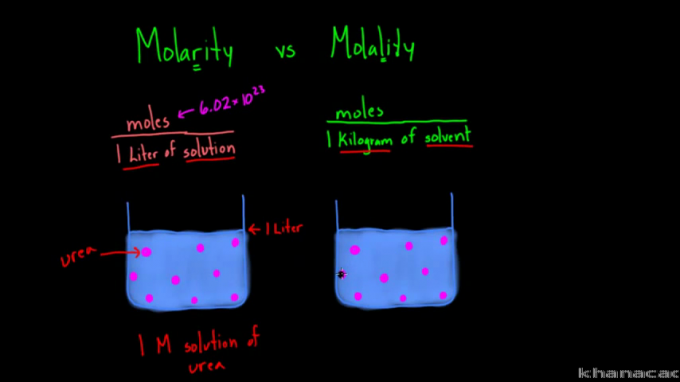
Mõisted "molaarsus" ja "molaalsus" ajavad mõned inimesed sageli segadusse nende sarnase kirjutamise ja häälduse tõttu. Kuigi mõlemat kasutatakse lahuse kontsentratsiooni mõõtmiseks, on nende kahe vahel erinevusi.
Ülaltoodud valemi põhjal on näha, et molaarsuse ja molaalsuse erinevus seisneb lähenemises. Molaarsus ehk molaarne kontsentratsioon mõõdab aine moolide arvu lahuse liitri kohta. Molaalsus mõõdab aga aine moolide arvu kilogrammi lahusti kohta.
Reklaam
Loe: Ärivalem
Näiteid molaarsusprobleemidest ja arutelust

Nüüd, olles teadnud molaarsuse ja molaalsuse valemit, oleks parem, kui prooviksite kohe probleemiga tegeleda, et materjali paremini mõista. Tule, täida lihtsalt järgmised küsimused!
Molaarsuse probleem
1. Kui on teada, et lahustunud aine mass on 11 grammi, on lahuse maht 500 ml ja Mr = 22. Mis on molaarsus?
Vastus:
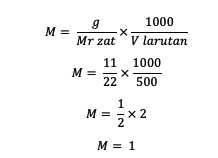
Seega on aine molaarsus 1 mol/L.
2. 5 M HCl mahuga 20 ml lahjendati 0,4 M-ni. Niisiis, kui palju vett tuleks lahusele lisada?
Vastus:
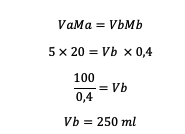
Seega tuleb lisada 250 ml vett.
3. Glükoos (C6H12O6), mille suhteline mass on 180, sisaldub 500 ml 0,1 M glükoosilahuses. mis on glükoosi mass?
Vastus:

Niisiis, glükoosi (C6H12O6) on 9 grammi.
4. Kui suur on lahusti maht H lahuses?2NII4 0,2 M mille lahustunud aine on 0,3 mooli?
Vastus:
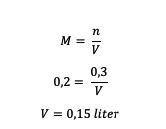
Seega on lahusti maht 0,15 liitrit.
5. Kokku 18 grammi glükoosi (C6H12O6), mille Mr = 180, lahustatakse vees nii, et maht muutub 0,5 L. Mis on lahuse molaarsus?
Vastus:

Kõigepealt arvutage kõigepealt moolide arv
Järgmisena arvutage molaarsuse väärtus.
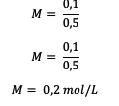
Seega on glükoosilahuse molaarsus 0,2 mooli liitri kohta.
6. Mitu grammi NaOH (Mr = 40) tuleb lahustada 100 ml 01, M NaOH lahuse valmistamiseks?
Vastus:

Seega kulub 0,4 grammi nõutavast NaOH massist.
Molaalsuse probleem
1. On teada, et lahuse mass on 11 grammi lahustunud ainet, 200 grammi lahustit ja Mr = 22. Niisiis, mis on molaalsus?
Vastus:
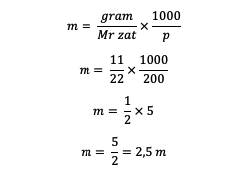
Seega saadakse molaalsusväärtus 2,5 m.
2. 17,1 grammile roosuhkru lahusele, mille Mr = 342, lisatakse kokku 250 grammi vett. Mis on lahuse molaalsus?
Vastus:

Seega on lahuse molaalsus 0,2 m.
3. Milline on 4 grammi NaOH (kui on teada, et Ar Na = 23, O = 16, H = 1) lahuse molaalsus on lahustatud 250 grammis vees?
Vastus:
Enne molaalsuse arvutamist peame esmalt arvutama suhtelise massi.
Mr = 23 + 16 + 1 = 40 grammi/mol
Pärast seda arvutame molaalsuse.
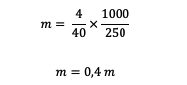
Niisiis on NaOH lahuses sisalduv molaalsus 0,4 m.
4. Kui suur on 37% HCl lahuse molaalsus, kui on teada, et Ar H = 1 ja Ar Cl = 35,5 ?
Vastus:
Mr = 1 + 35,5 = 36,5 grammi/mol
HCl mass = 37% x 100 grammi = 37 grammi
Lahusti mass = lahuse mass – HCl mass
Lahusti mass = 100–37 grammi
Lahusti mass = 63 grammi või 0,063 kilogrammi
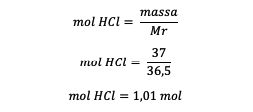
Pärast HCl moolide teadmist arvutage molaalsus
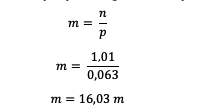
Seega on näha, et HCl molaalsus on 16,03 molaarsust.
5. Mis on 15 grammi uurea CO (NH .?) molaalsus?2)2 250 grammis vees lahustatud? (Härra = 60)
Vastus:
Kõigepealt arvutage karbamiidi moolid
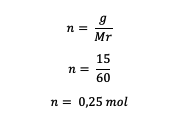
Järgmisena arvutage lahuse molaalsus
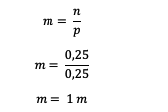
Seega on uurea lahuse molaalsus 1 m.
Noh, see on molaarsuse ja molaalsuse valem, millele on lisatud probleemi definitsioon ja näited. Lihtne, kas pole? Loodetavasti saate selle artikli kaudu oma arusaamist paremaks muuta, jah. Vaim!
X SULGE
Reklaamid
REKLAAM
X SULGE
