Valentselektronid: määratlus, arvutamine, näidisprobleemid
Laadimine...
Valentselektronid on aatomi kõige välimise tasandi elektronid, mis võivad osaleda interaktsioonis teiste aatomitega. Valentsväärtus võib esindada aatomit, nii et interaktsiooni väärtust saab näha.
Valentside arv aatomis võib põhjustada elemendi reaktiivse või passiivse oleku. Sel põhjusel on väga oluline teada valentside arvu, et teada saada seotud elemendi aktiivsust.
Sisuloend
Valentselektronide mõistmine
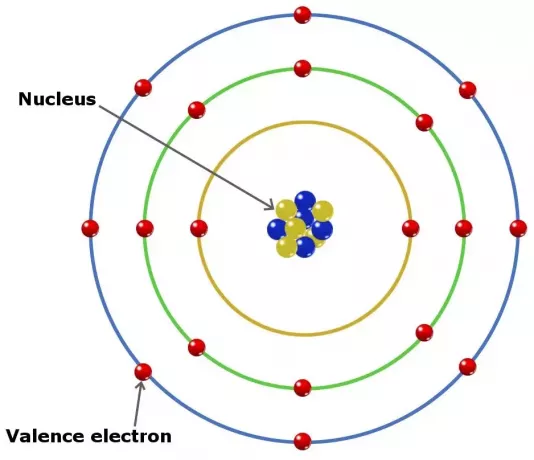
Aatomite valentselektronid võivad mängida rolli keemilise sideme moodustamisel elemendis. Põhirühma elementides on valentselektronid välimise kesta elektronid.
Isegi nii, kuid mitte kõik seda tüüpi elektronid ei asu väliskestas. Mõnes üleminekurühma kuuluvas elemendis on valents sügavamal kui väliskest.
Loe: Elektronide konfiguratsioon
Valentsi elektronide tabel
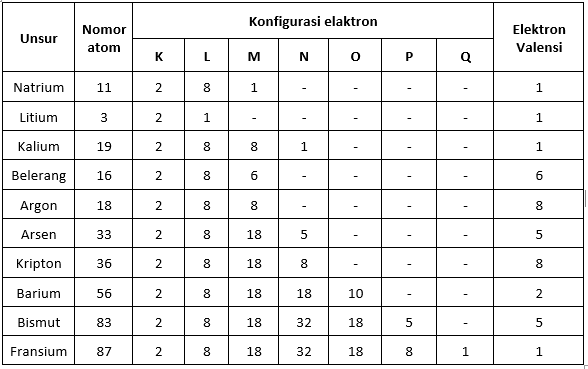
Valentselektronid ja elementide perioodiline süsteem
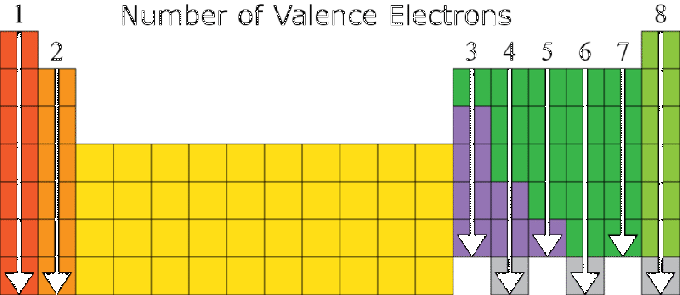
Elemendi omadused sõltuvad suuresti selle elektronkonfiguratsioonist, eriti valentsarvust. Sama valentside arvuga elementidel on üldiselt sarnased omadused. Sel põhjusel on elementide perioodiline süsteem korraldatud vastavalt kasvavale aatomarvule ja aine omaduste sarnasusele.
Elemendi aatomi elektronkonfiguratsiooni ja elemendi positsiooni vahel perioodilises süsteemis on seos, kus:
- Rühma number on sama, mis valentsväärtuste arv, välja arvatud VIIIA rühma element He ja üleminekurühm.
- Perioodiarv on võrdne elektroni kestade arvuga.
Elektrijuhtivus
Valentselektronid vastutavad ka elemendi elektrijuhtivuse eest. Seetõttu saab elemente rühmitada mittemetallideks, pooljuhtideks ja metallideks. Metallielementidel on tahkes olekus üldiselt kõrge elektrijuhtivus.
Perioodilise tabeli igas reas on metall mittemetallist vasakul. Seega on metallidel vähem valentsi kui mittemetallidel.
Metalli aatomite valentsväärtus on aga väikese ionisatsioonienergiaga ja tahkes olekus võivad need elektronid suhteliselt vabalt lahkuda ühest aatomist või ühineda teiste aatomitega.
Selliseid vabu elektrone saab liigutada elektrivälja mõjul, nende liikumine võib sisaldada elektrivoolu. Need elektronid vastutavad metallide elektrijuhtivuse eest. Heade juhtide näideteks on alumiinium, vask, kuld ja hõbe.
Mittemetallilistel elementidel on madal elektrijuhtivus, mistõttu need toimivad isolaatoritena. Sellised elemendid on näha perioodilisuse tabelis paremal ja nende valentskest on vähemalt poolenisti täis.
Ionisatsioonienergiat peetakse suureks, kui elektronid ei saa elektriväljaga silmitsi seistes aatomist kergesti lahkuda. Seega on sellisel elemendil võime juhtida väga väikeseid voolusid.
Isolatsioonielementide näideteks on väävel ja teemant. Metalle sisaldavaid tahkeid ühendeid võib öelda ka isolaatoriteks, kui ioonse sideme moodustamiseks kasutatakse metalliaatomite valentsi.
Loe: Kvantmehaanika
Elektronide konfiguratsioon
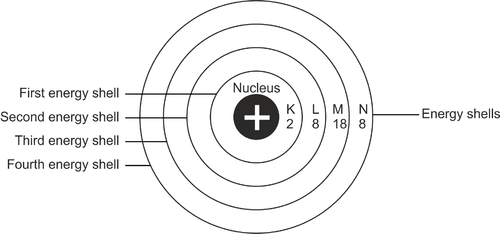
Konfiguratsiooniprotsessiks võib öelda, et elektronide jaotuse paigutus aatomis. Üldiselt asuvad elektronid aatomis teatud teel. See määratakse aatomi energiataseme alusel. Need teed on elektronkihid.
Nahakihi esimene osa on tähistatud tähega K. Nahakihid jätkuvad tähestikulises järjekorras L, M ja nii edasi. K-kest on aatomituumale kõige lähemal. Iga kesta kiht mahutab ainult teatud arvu elektrone.
Reklaam
Nii et kui see on täis, liiguvad elektronid järgmisse kihti. Kõik nahakihid tuleb täita maksimaalselt.
Kuidas lugeda valentselektrone

Elektronide asukoht, kui nad hakkavad aatomit täitma, algab esimesest kestakihist. See nahakiht on aatomituumale kõige lähemal või on tähistatud tähega K. Esimesel kihil on madalaim energiatase. Kui esimene kiht on täidetud 2 elektroniga, jätkatakse seda järgmise kihi, mille nimi on L, täitmisega.
L-kesta mahutavus on 8 elektroni. Kui see on täis, jätkatakse seda järk-järgult järgmise nahakihini. Aatomi välimise kesta kogumaht on 8 elektroni.
Põhirühma kuuluvad elemendid, nende elektronkonfiguratsiooni saab määrata elektronide arvu või aatomarvu alusel järgmiste reeglite järgi.
- Elektronid laetakse täielikult maksimaalse piirini, mille nahakiht suudab vastu võtta.
- Kui elektrone on veel alles või ei suuda elektronkihi kihti maksimaalselt täita, pöörake tähelepanu järgmistele sätetele.
- Kui järelejäänud elektronide arv on > 32, on kesta järgmine osa täidetud 32 elektroniga
- Kui ülejäänud elektrone on < 32, mahutab järgmine kestakiht 18 elektroni;
- Kui ülejäänud elektrone on < 18, täidetakse järgmine kiht 8 elektroniga.
- Kui järelejäänud arv on 8, võivad ülejäänud elektronid täita kesta järgmise osa.
Loe: Füüsiline muutus
Näited valentselektroni probleemidest

Materjali sügavamaks mõistmiseks vaadake mõningaid näiteid ja järgnevat arutelu.
Näide 1
Määrake järgmiste elementide valentsväärtused nende elektronide konfiguratsiooni põhjal.
- 11Na
- 13Al
- 15P
- 18Ar
- 19K
Vastus:
- 11Na = 281
Na valentside arv = 1
- 13Al = 2 8 3
Valentside arv Al = 3
- 15P = 285
Koguvalents P = 5
- 18Ar = 288
Valentside arv Ar = 8
- 19K = 2 8 8 1
Valentside arv K = 1
Näide 2
Looge elektronkonfiguratsioon ja määrake väärisgaasi elektronide konfiguratsioonide abil järgmiste elementide valentsväärtused.
- 20Ca
- 35br
- 36Kr
- 50Sn
- 86Rn
Vastus:
- 20Ca = [Ar] 4s2
Ca valentsväärtuste summa = 2
- 35Br = [Ar] 3d10 4s2 4p5
Br valentsväärtuste summa = 7
- 36Kr = [Ar] 3d10 4s2 4p6
Valentsväärtuste summa Kr = 8
- 50Sn = [Kr] 4d10 5s2 5p2
Sn valentsväärtuste summa = 4
- 86Rn = [Xe] 4f14 5d10 6s2 6p6
Valentsväärtuste summa Rn = 8
Näide 3
Palun kirjutage alla elementide elektronid ja määrake ka nende valentsväärtused.
- 10 Ne
- 33 USA
- 47 Ag
- 52 Te
- 54 Xe
Vastus:
- 10 Ei: 1s2 2s2 2p6
Ne valentsväärtuste summa = 8
- 33 Äss: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p3
As valentsväärtuste summa = 5
- 47 Ag: 1 s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d10
Ag valentsväärtuste summa = 1
- 52 Te: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p4
Te valentsväärtuste summa = 6
- 54 Xe: 1 s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6
Xe valentsväärtuste summa = 8
Valentselektroneid saab määrata kindlaksmääratud tee või orbiidi alusel, kasutades elektronide konfiguratsiooni. Kuigi see tundub üsna keeruline, on selle materjali valdamine midagi, mida tuleb teha, et küsimustega hõlpsalt töötada.
X SULGE
Reklaamid
REKLAAM
X SULGE
