ÜHENDID: määratlus, tüübid, näited
Laadimine...
Enda teadvustamata puutuvad inimesed igapäevaelus sageli kokku erinevat tüüpi ühenditega. Kuigi võib-olla ei mõista kõik, rääkimata sellest, et mõistavad, mida ühend tähendab. Tegelikult on palju näiteid ühenditest, mida sageli leidub, nagu sool, suhkur, vesi jne.
Üldiselt liigitatakse ühendid koostiselementide põhjal mitut tüüpi. Samal ajal kui ühendite lagunemisprotsess viiakse läbi keemilise reaktsiooni kaudu. Samuti eristab see igat tüüpi ühendite vormi, tekstuuri, maitset ja lõhna.
Sisuloend
Liitvalemite nimetamine
Ühend on üksik aine, mis võib keemilise reaktsiooni käigus laguneda kaheks või enamaks aineks. Näiteks igapäevaelus sageli leiduvast ühendist on vesi. Protsessis on vesi hapniku (O) ja vesiniku (H) elementide kombinatsioon keemilise valemiga H20.
Indoneesia Vabariigi Haridus- ja Kultuuriministeeriumi ametlikul veebisaidil teatatakse, et elemendi väikseim osa on aatom. Kui kaks aatomit ühinevad keemilise reaktsiooni kaudu, moodustab see molekuli või ühendi väikseima osa.
Vahepeal toimub ühendite moodustamise protsess keemilise segamise ja termilise või elektrilise lagunemise teel. Ühendite omadused erinevad nende koostisosadest.
Näiteks vee omadused erinevad seda moodustavate elementide, nimelt hapniku ja gaasilise vesiniku omadustest. Välimuse erinevus on samuti väga reaalne. Kuna vesi on vedelik, on vesinik gaas. Lisaks saab vett kasutada tulekahjude kustutamiseks.
Vesinik on aga tuleohtlik aine. Kuigi hapnik on põlemisprotsessis vajalik aine. Seega on näha, et koostiselementidel ja tekkivatel ühenditel on väga vastupidised omadused, vormid ja funktsioonid.
Niisiis, mis vahe on ühendil ja segul ning elemendil? Kuigi ühendid ja elemendid on üksikud ained. Siiski on erinevusi nii ühendite ja elementide kui ka segude vahel.
Selle põhjuseks on asjaolu, et element on üksik aine, mida ei saa muuta lihtsamaks aineks ja element säilitab siiski oma esialgsed omadused või omadused.
Elementide näide:
- Kuldne
- Plii
- Raud
- Vask
- Tsink
- Nikkel
Segu on materjal, mis koosneb kahest või enamast ainest, kuid millel on siiski algse aine omadused. Segude näited on järgmised:
- Õhk
- Jõe vesi
- Rock
- Šokolaadipiim
- Joodi sool
- Kohv
- Magus tee
Loe: Vedelik
Ühendite tüübid
Enne igapäevaelus kasutatavate ühendite absoluutsete näidete edasist arutamist. Hea, kui suudad eristada ka ühendite liike.
Koostiselementide põhjal liigitatakse ühendid mitut tüüpi, nimelt järgmiselt:
1. Orgaaniline ühend

Pärineb elusolenditest ja fotosünteesi protsessist. Orgaanilised ühendid sisaldavad põhiahelana elementi süsinik (C). Seda tüüpi orgaaniliste ühendite iseloomulikud omadused on vees lahustumatud ja lahustuvad ainult orgaaniliste lahustitega segatuna.
Kuna see moodustub elemendist süsinik (C), muudab see orgaanilised ühendid kergestisüttivamaks. Orgaanilise ühendi näide on suhkur (C12H22011)
2. Anorgaaniline ühend
Reklaam

Seda tüüpi ühend pärineb maavaradest. Anorgaanilistel ühenditel on suhteliselt kõrgem keemispunkt kui orgaanilistel ühenditel. Anorgaanilised ühendid kipuvad aga olema mittesüttivad ja vees kergesti lahustuvad. Näiteks ränidioksiid (SiO2).
3. Hapu

Molekulid, mis võivad loovutada vesinikioone H+ ja moodustab Lewise happega kovalentse sideme. Keemias koosnevad happeühendid kolmest definitsioonist, nimelt Arrhenius, Bronsted-Lowry ja Lewis.
Üldiselt on hapetel järgmised omadused:
- Vees lahustatuna hapu.
- Reageerib ägedalt metallidega segamisel.
- See kipitab katsudes ja võib nahka kahjustada.
- pH on alla 7.
- Happed on elektrolüüdid, kuigi mitte tingimata ioonsed.
- Võib muuta sinise lakmuspaberi punaseks.
Hapetel on mitmesuguseid kasutusviise, sealhulgas metallesemetelt rooste eemaldamine peitsimise või peitsimise teel. Lisaks saab hapet kasutada ka märgpatareides elektrolüüdina. Väävelhapet saab kasutada bensiini valmistamisel katalüsaatorina.
Loe: Happeline alus
4. Ioonilised ühendid

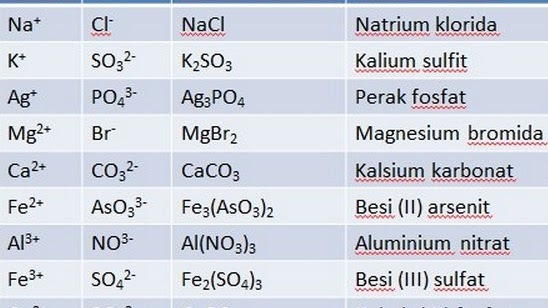
See termin viitab keemilisele ühendile, mis koosneb elektrostaatiliselt koos hoitud ioonidest (ioonsidemed). Kuigi see ühend on üldiselt neutraalne, koosneb see positiivselt laetud ioonidest (katioonidest) ja negatiivselt laetud ioonidest (anioonid), mõlemad naatriumi, kloriidi ja karbonaadi kujul.
Ioonsete ühendite omadused:
- Sellel on väga kõrge keemistemperatuur madala aururõhuga.
- Aluselisus või sarnasus happeliste ühenditega.
- Enamik ioonsete ühendite tüüpe on väga rabedad.
- Ioonsete ühendite kokkusurutavuse määrab struktuur.
- Kergesti lahustuv polaarsetes vedelikes, näiteks vees. Kuid seda on bensiinis raske lahustada.
- Madal juhtivus ja üldiselt ei juhi märkimisväärset elektrit.
Ioonühenditel on mitmesuguseid kasutusviise ja inimesed kasutavad neid tavaliselt igapäevaelus. Ioonsete ühendite näideteks on magneesiumpiim, booraks kuni kustutatud lubi.
5. soola

Keemias liigitatakse sool ioonseteks ühenditeks, mis koosnevad negatiivsetest ioonidest (anioonidest) ja positiivsetest ioonidest (katioonidest), moodustades seega laenguta või neutraalseid ühendeid. Sool tekib aluste ja hapete, nagu kloriid, atsetaat, fluoriid, sulfaat, reaktsioonil naatriumkloriidiks.
Kõigist olemasolevatest soolatüüpidest on igal soolal erinev maitse, nimelt:
- Magus (plii ja atsetaat)
- soolane (naatriumkloriid)
- Hape (kaaliumbitartraat)
- Soolane (naatriumglutamaat)
- Mõru (magneesiumsulfaat).
6. Oksiid
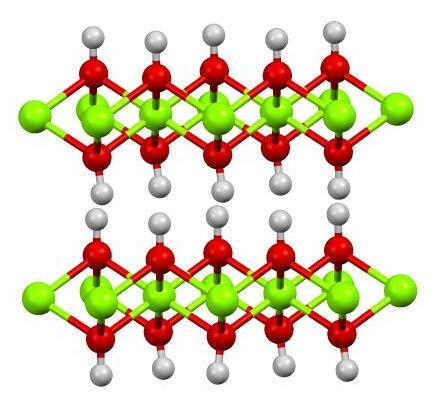
Oksiidühendid sisaldavad hapniku ja muude elementide aatomeid. Kas teadsite, et suurem osa maakoorest koosneb oksiididest? Need ühendid tekivad elementide oksüdeerimisel hapniku toimel. Oksiididel on tavaliselt kõrge keemistemperatuuriga ioonstruktuur.
7. keel

Ühendid, mis neelavad hüdroniumioone (H3O) vees lahustatuna. Alus on happe või keemilise elemendi duaal, mille pH on suurem kui 7. Üldiselt jagunevad alused kahte tüüpi, nimelt nõrgad alused ja tugevad alused. Sõltub selle võimest vabastada OH-ioone.
Alustel on mõned ühised omadused, mis on järgmised:
- On mõru maitsega.
- Pehme baastekstuur nagu seep.
- Võib muuta punase lakmuse värvi siniseks.
- Võimeline juhtima elektrivoolu.
- Võib neutraliseerida happeid.
- Põhjustab ilmastikumõju.
- PH väärtus ületab numbri 7.
Loe: Tahke
Näited ühenditest igapäevaelus

Igapäevaelus ei saa elusolendeid lahutada ühenditest. Pealegi on nii palju ühendeid, mida inimesed ellujäämiseks tarbivad.
Järgnevalt on toodud näited ühenditest, mida inimesed sageli kasutavad:
| Ühendi näide | Keemiline valem |
| Süsinikmonooksiid Gaas | CO |
| Gaas süsinikdioksiid | CO2 |
| Gaas lämmastikmonooksiid | EI |
| Vesi | H2O |
| Köögisool | Naatriumkloriid / NaCl |
| Vesinikkloriidhape | HCI |
| Väävelhape | H2NII4 |
| Äädikhape (äädikas) | CH3COOH |
| Gaas ammoniaak | NH3 |
| Naatriumhüdroksiid | NaOH |
| Suhkur | C12H22011 |
| Uurea | CO(NH2)2 |
| Alkohol | C2H3OH |
| Kaltsium | CaCo3 |
Teades näiteid ühenditest ja nende liikidest. Nüüd saate paremini aru, milliseid ühendeid sisaldavad toidud, joogid ja esemed, mida iga päev kasutatakse. Seega võite olla ka ettevaatlikum, valides, mida tarbida ja kasutada.
X SULGE
Reklaamid
REKLAAM
X SULGE
