Elektronide konfiguratsioon: definitsioon, tabelid, näited
Laadimine...
Kõik teavad, et aatomid on väikseim aine, mida ei saa enam keemiliselt jagada. Kuid väikseim aine koosneb mitmest osakesest, sealhulgas elektronidest. Elektronide konfiguratsioon mängib aatomisüsteemides olulist rolli.
Elektronid on osakesed, mis moodustavad negatiivse laenguga aatomeid. Koos positiivselt laetud prootonite ja neutraalsete neutronitega moodustavad need kolm aatomi komponendid. Elektronid asuvad aatomi väliskestas, prootonid ja neutronid aga aatomi tuumas.
Sisuloend
Mis on elektronide konfiguratsioon?
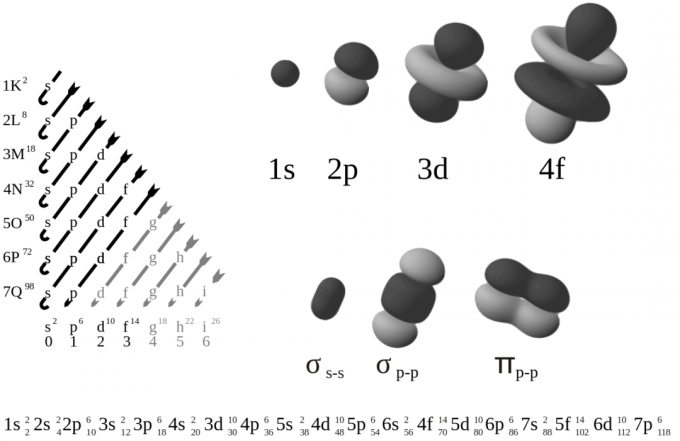
Elektroni olemasolu aatomiorbitaalil või kestal ei saa ennustada, kui just elektroni asukoha tuvastamise hõlbustamiseks ei võeta mõõtmist. Elektronid liiguvad ümber aatomituuma ja jäävad kindlale orbiidile. Tegelikult on orbiit veel üks termin aatomi kesta jaoks.
Aatomite kestad ja alamkestad on erineva energiatasemega. Elektronide konfiguratsioon viitab elektronide paigutusele molekulis, aatomis või muud tüüpi füüsikalises struktuuris. Elektroni kvantolek sõltub tema lainefunktsioonist.
Lainefunktsioon on keerukate väärtustega ruumi ja aja funktsioon. Elektronid on võimelised liikuma ühelt energiatasemelt teisele kvantneeldumise teel footonite kujul. Elektronide paigutuses on erinevate omadustega orbiitide kihid.
Loe: Füüsika muutus
1. Elektronide nahatüüp
Elektronkiht on jagatud mitmeks kihiks, mis asuvad erinevatel vahemaadel. Aatomi keskmele või tuumale lähima esimese kihi kest on K-kest. Teist kihti pärast K-kest nimetatakse L-kestaks. M kest tähistab kolmandat nahakihti jne.
Elektronkihi tüüpi tähistav tähestikuline järjekord näitab, et kest eemaldub aatomituumast. Mõistmise hõlbustamiseks võib peakvantarv (n) tähistada elektronkihti.
Teisisõnu, kvantarv on arv, mis kirjeldab elektronide asukohta aatomis. see arv näitab nende orbitaalidel olevate elektronide olemust ja tähistab dünaamilises süsteemis konserveerunud suurust.
Kvantarvud, mis tähistavad aatomi kestasid, algavad numbriga 1. See tähendab, et number 1 tähistab kesta K, number 2 tähistab L kesta, number 3 tähistab M kesta jne.
2. Energiatasemed elektronkestades
Elektronide positsioon nende orbiitidel või kestadel näitab erinevat energiahulka. Seega on elektronkihi asukoht tihedalt seotud elektronide energiatasemega kesta orbiidil. Lühidalt öeldes määrab elektronkihi kaugus aatomi keskpunktist elektroni energia.
Mida suurem on arv n, seda kaugemal on elektronkihi kaugus aatomi keskmest ja seda suurem on elektroni energia vastavas kestas. Tavaliselt täidavad elektronid esmalt K-kihi aatomite orbitaalid, millel on madalaim energiatase.
3. Elektronide arv igas kestas
Põhimõtteliselt on elektronkihte täitvate elektronide arvul teatud piir. Maksimaalne elektronide arv aatomi välimises kestas on 8. Teatud kestas elavate elektronide arvu määramiseks võite kasutada järgmist valemit:
N-s elektronkiht = 2n²
Loe: Inertsi hetk
Elektronide konfiguratsioonitabel
Elektronide paigutus elemendis on kirjutatud reeglite järgi, milles teadlased kokku lepivad. Aatomite elektronide konfiguratsiooni või paigutuse kontseptsioon on elementide perioodilise tabeli struktuuri mõistmisel ülioluline. Konfiguratsioonitabel või elektronide ja nende elementide paigutus on loetletud allpool.

Elektronide konfigureerimise probleemi näide
Keemiaainetes esitatakse sageli küsimusi, mis on seotud elektronide paigutusega. Hea mõte on harjutada vastamist järgmistele küsimustele elektronide konfiguratsiooni või paigutuse kohta.
Milline on elektronide konfiguratsioon ja arv igas elektronkihis elementide Sr (Z=38) ja Ni (Z=28) aatomites?
Vastus:
Sr(Z = 38)
1s²; 2s²; 2p⁶ ;
3s²; 3p⁶ ;
4s² ;3d¹⁰; 4p⁶; 5s²
või [Kr] 5s²
K = 2
L = 8
M = 18
Reklaam
N = 8
O = 2
Ni(Z = 28)
1s²; 2s² ;
2p⁶; 3s²; 3p⁶ ;
4s²; 3d⁸
või [Ar] 4s² 3d⁸
K = 2
L = 8
M = 16
N = 2
Loe: Kvantmehaanika
Täielikud / pool täis reeglid

Igal elektronorbitaalil või alamkihil on oma piirangud seda hõivavatele elektronidele. See võib aidata umbes täielikke ja pooleldi täielikke reegleid. Laias laastus on 4 tüüpi alamkihte, sealhulgas s, d, f ja p, kus iga alamkiht sisaldab erinevat arvu elektrone.
1. s alamkest
S-orbitaal mahutab elektrone maksimaalselt 2.
2. lk alamkest
Maksimaalne elektronide arv p alamkestas on 6.
3. d alamkest
Maksimaalne elektronide arv d alamkihis on 10.
4. f alamkest
F alamkest mahutab maksimaalselt 14 elektroni.
Orbitaalide ja neis olevate elektronide arvu kirjutamine toimub nii, et kõigepealt lisatakse kestaarv, seejärel orbitaal ja lõpuks elektronide arv.
Näiteks:
1s² ;2s² ;2p⁶ ;
3s² ;3p⁶ ;
4s² ;3d¹⁰ ;4p⁶
jne
Seega näitab elektronide paigutuse täis- või osareegel, et elektron on võimeline liikuma ühelt orbitaalilt teisele, et saavutada palju stabiilsem paigutus. See reegel kehtib konfiguratsioonidele, mis lõpevad alamkooriga d.
Loe: Potentsiaalne energia
Orbitaalskeem
Elektronide paiknemine kesta esimestes kihtides aatomist kõige kaugemal järgib kvantmehaanikat. Termin orbitaaldiagramm viitab aatomiorbitaalidel olevate elektronide kirjeldusele.
Sellel diagrammil tähistab üles või alla nool elektroni. Kuigi orbitaal, kus elektronid on kasti kujul. Orbitaalil s on 1 ruut, d-l on 5 ruutu, p-l on 3 ruutu ja f-l on 7 ruutu.
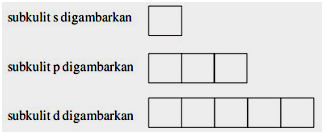
Orbitaaldiagrammide tegemisel tuleb tähelepanu pöörata reeglitele, mis sisaldavad Hundi reeglit ja Pauli välistamispõhimõtet. Nende reeglite täpsem selgitus on allpool.
Loe: Võimsuse mõõde
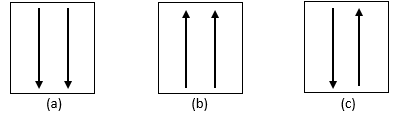
Paulise keelupõhimõte
Pauli välistusprintsiibi järgi ei saa aatomiorbitaalil olla rohkem kui kaks elektroni. seega saavad elektronid liikuda ühelt orbitaalilt teisele ainult siis, kui see sisaldab tühjus. Näiteks aatom, mille 1s orbitaalil on kaks elektroni, on näidatud alloleval joonisel:
Hundi reeglid
Hundi reegel ütleb, et sama energiaga orbitaalid täidavad kõigepealt ühe elektroniga, millel on sama energia on sama suund või spin, siis sisenevad elektronid orbitaalidele järjestikku selles suunas vastupidine.
See tähendab, et samas alamkestas on igal orbitaalil üks elektron, mille suunas on sama nool, siis ülejäänud elektronid täidavad noolele vastassuunas elektronide paar. Täpsem selgitus on järgmisel pildil.

Elektronid on aatomis teatud paigutuses. Seda paigutust kirjeldav termin on elektronide konfiguratsioon. Mõistes konfiguratsioonitabeleid, orbitaaldiagramme ja muid reegleid, saab elektronide konfiguratsiooni või paigutuse küsimusele hõlpsalt vastata.
X SULGE
Reklaamid
REKLAAM
X SULGE
