Reaktsioonikiirus: määratlus, valemid, tegurid, näidisülesanded
Kui olete kunagi näinud triikrauda, mis oli alguses normaalne, kuid muutus roostes või märkasite värvimuutust Segalahuses näete alateadlikult keemilist kontseptsiooni, mida nimetatakse "kiiruseks". reaktsioon ".
Reaktsioonikiirusega seotud teadus on tööstusmaailmas väga kasulik, sest tööstustegevuses kasutatakse tootmisprotsessis keemilisi reaktsioone.
Tööstuses eksisteerivad aja, pingutuse ja kulude muutujad on samuti väga tähendusrikkad, seetõttu on ka mõiste kiire ja kontrollitud reaktsioonikiirus on tööstuse mängijatele väga kasulik seda.
Sisukord
Reaktsioonikiiruse mõistmine

Reaktsioonikiirus on reaktantide ja saaduste kontsentratsiooni muutus ajaühikus.
Reagentidega reageerimisel tekitavad A ja B aja jooksul saadused C ja D nagu allpool toodud reaktsiooni võrrandis reaktiivmolekulide A ja B arv väheneb ning produktimolekulide C ja D arv suureneb, seejärel on reaktsiooni kiiruse valem (v) Saab:

Reagentide A ja B (reaktandid) kontsentratsiooni muutumise kiiruse negatiivne märk on mõeldud positiivseks, kuna reaktsioonikiirus on suurus, mille väärtus peab alati olema positiivne.
Selle ühik on M s-1 või moolid L-1 s-1.
Kuid reaktsiooni kiirusel on veel üks võrrand, nimelt:
Keemiliste reaktsioonide korral:
aA + bB → pP + qQ
Reaktsioonikiiruse ja molaarsuse suhe:
v = k [A]n[B]m
Teave:
- v = reaktsioonikiirus
- k = reaktsioonikiiruse konstant
- m = aine A reaktsioonijärjestus
- n = aine B reaktsioonijärjestus
Aine ja aine B vahelise reaktsiooni järjekorra saab määrata ainult katseliselt.
Kokkupõrke teooria
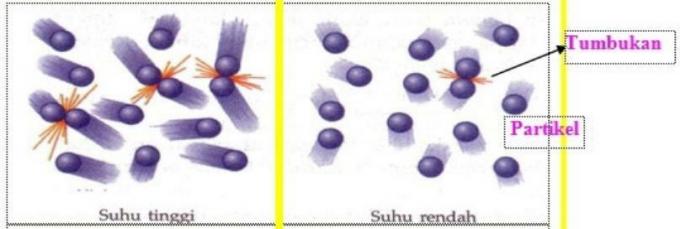
Kokkupõrgeteooria väidab, et reaktiivi osakesed peavad reageerimiseks üksteisega kokku põrkama.
Reageerivate osakeste vahel toimuvaid kokkupõrkeid, mis edukalt põhjustavad reaktsiooni, nimetatakse efektiivseteks kokkupõrgeteks.
Minimaalset energiat, mis peab reaktiivi osakestes olema efektiivseks kokkupõrkeks, nimetatakse aktivatsioonienergiaks (Ea).
Üldiselt sõltub reaktsioonikiirus mitmest asjast, näiteks:
1. Osakeste kokkupõrke suund (suund)
Tüüpilises reaktsioonis peavad osakesed kokkupõrke ajal olema teatud suunas, et tõhus kokkupõrge tekitaks reaktsiooni.
Näiteks kokkupõrkel, mis toimub NO gaasimolekulide ja NO3 gaasimolekulide vahel reaktsioonis:
NO (g) + NO3 (g) → 2NO2 (g)
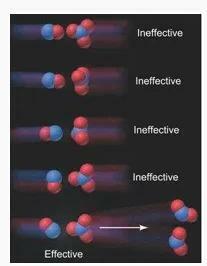
Kokkupõrke orientatsiooni olulisuse illustreerimine (Allikas: Silberberg, Martin S. 2009. Keemia: aine ja muutuse molekulaarne olemus (5. väljaanne). New York: McGraw Hill)
2. Osakeste põrkumise sagedus
Mida sagedamini osakeste kokkupõrked (kõrge kokkupõrke sagedus), seda suurem on efektiivsete kokkupõrgete võimalus, mis muudab reaktsioonikiiruse kiiremaks.
3. Reageerivate osakeste põrkumise energia
Kokkupõrkuvate reaktiiviosakeste energia peab ületama aktivatsioonienergiat, mis on reaktsiooni toimumise energiabarjäär, et reaktsioon saaks toimuda. Mida väiksem on aktiivsuse energia, seda kiirem on reaktsioonikiirus.
Reaktsioonikiiruse seadus
Reaktsioonikiiruses väljendatakse ühikut tavaliselt moolidena liitri kohta (loe: mol liitri kohta) või mida nimetatakse ka molaarsuseks.
Molaarsus on lahustunud aine moolide arvu mõõtmine ühes liitris lahuses.
Reaktsioonikiiruse kohta on olemas seadus.
Reaktsiooni kiirusseadus on võrrand, mis näitab seost või suhet konkreetse reaktsiooni kiiruse ja reagentide kontsentratsiooni vahel.
Siin on reaktsioonikiiruse seadus:
r = k [X]a[Y]b[Z]c
Teave:
- k = kiiruskonstant
- [X], [Y], [Z] = reagendi kontsentratsioon
- a, b, c = reaktsioonijärjestus
Kui pöörate tähelepanu ülaltoodud valemile, määratakse lisaks reaktsiooni kiirus, aga ka reaktsiooni järjekord.
Reaktsiooni järjekord on molaarsuse jõud reaktsiooni kiiruse võrrandis või lihtsamalt öeldes on reaktsiooni järjestus aine reaktsioonikiirus.
Reaktsiooni järjekord näitab suhet kontsentratsiooni muutuste ja reaktsioonikiiruse muutuste vahel.
Noh, Nende kahe suhet väljendatakse reaktsioonijärjestuse graafiku abil.
Reaktsioonijärjestuse graafikuid on kolm, lisateabe saamiseks vaadake allpool ülevaadet.
Reaktsioonijärjestus ja reaktsioonikiirus püsiv
1. Reaktsiooni korraldus
Reaktsioonijärjekorda ei määrata mitte reaktsioonikoefitsiendi, vaid katseandmete põhjal. Reaktsioonijärjestuse väärtus võib olla murd, positiivne arv, null või negatiivne.
Matemaatiliselt on kogu reaktsioonijärjestuse väärtus reagentide üldiste reaktsioonijärjestuste summa.
Näide:

Siin on kolm reaktsioonide järjekorda koos graafikutega, sealhulgas:
a. Null kogu reaktsiooni järjekord
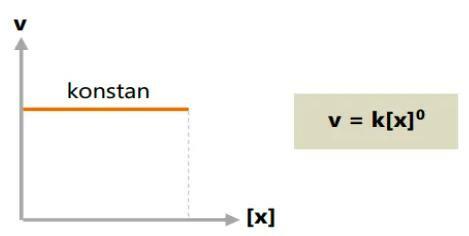
Nulljärjekorras reaktsioonis aine kontsentratsioon (konstant) reaktsioonikiirust ei mõjuta.
b. Totaalne reaktsioonikorraldus üks
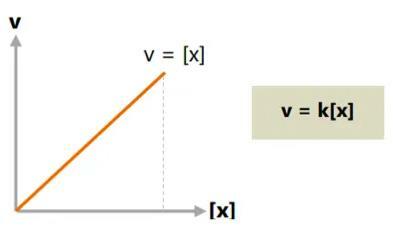
Esmakordse reaktsiooni korral on reaktsiooni kiiruse suurenemine võrdne või otseselt proportsionaalne aine kontsentratsiooni muutusega.
Kontsentratsiooni kahekordistamisel on ka reaktsiooni kiirus kaks korda kiirem kui varem. Samamoodi edasi.
c. Kogu reaktsioonijärjekord kaks
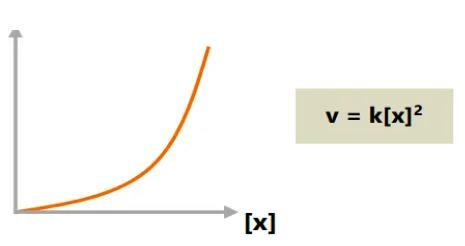
Reaktsiooni kiiruse suurenemine võib olla proportsionaalne, kui reaktiivide kontsentratsiooni suurenemine on ruut.
Näiteks kui reaktiivi kontsentratsioon kahekordistub, siis reaktsiooni kiirus neljakordistub.
Märge: Reaktsiooni järjestust ei saa reaktsioonivõrrandi vormi järgi määrata. Reaktsiooni järjekorda saab määrata ainult katsetulemuste põhjal, muutes rõhu muutujat (eriti gaasiliste reaktsioonide korral) või selle molaarsust (reaktsioonid lahuste ja gaasidega).
2. Reaktsioonikiirus püsiv
Reaktsioonikiiruse konstant (k) on konstant, mille väärtus sõltub reagendi tüübist, temperatuurist ja katalüsaatorist.
Selle reaktsiooni kiiruskonstant pöördvõrdeline aja muutustega. Mida kiiremini reaktsioon toimub, seda suurem on k väärtus.
Samal ajal on reaktsioonikiiruse konstandi väärtus võrdeline temperatuuri muutustega. Mida kõrgem on reaktsiooni temperatuur, seda suurem on k väärtus.
Reaktsioonikiirust mõjutavad tegurid
Reaktsiooni kiirust võivad mõjutada mitmed tegurid, mida selgitatakse teooria ja eksperimentide ning lisateabe abil.
1. Eksperimentaalselt

Eksperimentaalselt võivad reaktsioonikiirust mõjutada mitmed tegurid, sealhulgas:
a. Sõltumatu muutuja või manipuleerimine
Kas muutuja, mida saab katses muuta.
Näide:
- Marmorilaastude suurus (pindala tegur).
- Aine kontsentratsioon (kontsentratsioonitegur).
b. Kontrollitav muutuja
See on muutuja, mida hoitakse kogu katse vältel konstantsena.
Näide:
- Lahus, mis muudab selle kontsentratsiooni, kuigi kontsentratsioon muutub, jääb lahuse tüüp samaks.
c. Sõltuv muutuja / vastus
Kas muutuja tuleneb eksperimentaalsest tegevusest.
Näide:
- Kõigist reaktsioonikiirust mõjutada võivate tegurite katsetest saadud andmed reaktsioonikiiruste ja reaktsiooniaja (aja) kujul.
2. Teoorias

Siin on mõned tegurid, mis võivad teoreetiliselt mõjutada reaktsioonikiirust:
a. Puudutage valikut Pindala
Puudutuse pinnal on väga oluline roll, mis võib põhjustada reaktsioonikiiruse kiiruse.
Samamoodi, kui väiksem on kokkupuuteala pind, seda väiksemad on osakeste kokkupõrked, seega on ka reaktsioonikiirus väiksem.
Mõju avaldavad ka reageerivate osakeste omadused. Mida peenem kiip, seda kiiremini reageerimiseks kulub. Kui kiip on jämedam, siis kauem kulub reageerimiseks.
b. Keskendumine
Kuna reaktsiooni kiiruse võrrand on määratletud kui reagentide kontsentratsioon, suureneb kontsentratsiooni suurenemisel ka reaktsiooni kiirus.
See tähendab, et mida suurem on kontsentratsioon, seda rohkem on reaktiivmolekule saadaval.
Nii suureneb ka kokkupõrgete võimalus, mis põhjustab reaktsioonikiiruse kasvu.
Nii et mida suurem on kontsentratsioon, seda kiirem on reaktsioonikiirus.
c. Temperatuur
Temperatuur mängib rolli ka reaktsioonikiiruse mõjutamisel.
Kui toimuva reaktsiooni temperatuuri tõstetakse, põhjustab see osakeste muutumist seda aktiivsemalt liikudes, nii et kokkupõrkeid tuleb ette sagedamini, mistõttu reaktsioonikiirus suureneb suur.
Teisest küljest, kui temperatuuri alandatakse, on osakesed vähem aktiivsed, seega on reaktsioonikiirus väiksem.
Temperatuur on aine füüsikaline omadus, mis väljendab kvantitatiivselt üldist kuumuse ja külma ideed.
d. Molaarsus
Molaarsus on lahustunud lahustunud moolide arv lahusti mahuühiku kohta.
Seos reaktsiooni kiirusega on see, et mida suurem on aine molaarsus, seda kiiremini reaktsioon toimub.
Seega kulgeb reaktsioon madala molaarsuse korral aeglasemalt kui suure molaarsusega.
e. Katalüsaator
Katalüsaator on aine, mis võib teatud temperatuuril keemilise reaktsiooni kiirust kiirendada, ilma et reaktsioon ise seda muudaks.
Katalüsaatoril on reaktsioonis roll, kuid mitte reaktiivi või saadusena. Katalüsaatorid võimaldavad reaktsioonidel toimuda kiiremini / võimaldavad reaktsioone madalamal temperatuuril, kuna need põhjustavad reaktantides.
See katalüsaator pakub madalama aktiveerimisenergiaga valitud rada. Katalüsaatorid võivad vähendada reaktsiooni tekkimiseks vajalikku energiat.
Katalüsaatoreid on kaks, sealhulgas:
- Heterogeenne katalüsaator
See on katalüsaator, mis on katalüüsitavas reaktsioonis erinevates faasides.
Heterogeense katalüsaatori näide: See katalüsaator annab pinna, millele reaktiivid (või substraat) on ajutiselt kinni keeratud. Substraatide sidemed on piisavalt nõrgad, et võimaldada uute toodete moodustumist. Seos toote ja katalüsaatori vahel on nõrgem, mistõttu see lõpuks vabaneb. - Homogeenne katalüsaator
Tavaliselt reageerib see ühe või mitme reagendiga, moodustades keemilise vaheühendi, mis seejärel reageerib katalüsaatori taaskasutamise protsessis reaktsiooni lõppsaaduseks.
Järgnev on katalüütilise reaktsiooni üldskeem, kus C tähistab katalüsaatorit:
A + C → AC… (1)
B + AC → AB + C… (2)
Ehkki katalüsaator (C) kulub reaktsioonis 1, regenereeritakse see seejärel reaktsioonis 2, nii et kogu reaktsioon muutub:
A + B + C → AB + C
Mõned välja töötatud katalüsaatorid hõlmavad Ziegler-Natta katalüsaatorit, mida kasutatakse polüetüleeni ja polüpropüleeni masstootmiseks.
Tuntuim katalüütiline reaktsioon on Haberi protsess, mis on ammoniaagi süntees, kasutades katalüsaatorina tavalist rauda.
Katalüsaator, mis võib hävitada sõidukite väga keerulisi heitgaasiprodukte, on valmistatud plaatinast ja roodiumist.
Probleemide näide
Eeltoodust arusaamise hõlbustamiseks on siin näited küsimustest, mida saate uurida, sealhulgas:
1. Mõelge allpool toodud H2-gaasi moodustumise katsete tabeli andmetele.
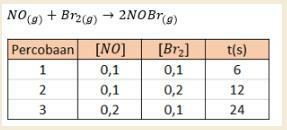
H. Gaasi moodustumise reaktsiooni katse
Määrake reaktsiooni järjekord, reaktsiooni kiiruskonstant ja ka reaktsiooni kiirus!
Vastus:
a. Määrake lämmastikmonooksiidi (NO) reaktsioonijärjestus!
NO reaktsiooni järjekorra määramiseks tuleb kindlaks teha, kui Br2 kontsentratsioon on sama, nimelt katsetes 1 ja 3, kui broomi kontsentratsioon on 0,1 M.
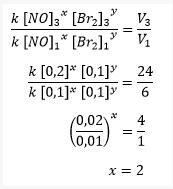
Naatriummonooksiidi reaktsioonijärjekorra arvutamine
b. Broomi (Br2) reaktsioonijärjekorra määramine
Broomi (Br2) reaktsioonijärjekorra leidmiseks tuleb määrata, kui NO kontsentratsioon on sama, nimelt katsetes 1 ja 2, kui lämmastikmonooksiidi kontsentratsioon on 0,1 M.
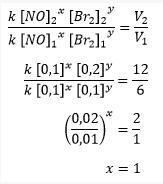
Broomireaktsiooni järjekorra arvutamine
Siis saadakse see siis, kui naatriummonoksiidi (NO) reaktsioonijärjestus on 2 ja broomi (Br2) reaktsioonijärjestus on 1.
c. Esimeste katseandmete abil määratakse reaktsiooni nitrosüülbromiidi (NOBr2) kiiruskonstant
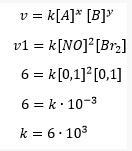
Nitrosüülbromiidi reaktsioonikiiruse konstandi arvutamine
Nii et kiiruse võrrandi konstant nitrosüülbromiidi moodustumisel on 6000, saab reaktsioonikiiruse arvutada järgmiselt:
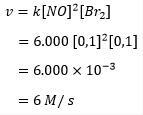
Seega on näha, et broomi moodustumise reaktsioonikiirus on 6 mooli sekundis. Mis tähendab, et naatriummonooksiidi ja broomi vahelises reaktsioonis võib iga sekund moodustada kuni 6 molaarset nitrosüülbromiidi.
