Molaarsuse, valemite, valmistamise, lahuste lahjendamise ja näidete mõistmine
Molaarsuse, valemite, valmistamise, lahuste lahjendamise ja näidete mõistmine - Selles arutluses selgitame molaarsuse tähendust. Mis hõlmab arusaamist molaarsusest, molaarsuse valemist, molaarsuse probleemide näidetest, lahuste valmistamisest ja lahjendamisest, mida arutatakse täielikult ja kergelt. Lisateabe saamiseks lugege palun hoolikalt allolevat ülevaadet.
Sisukord
-
Molaarsuse, valemite, valmistamise, lahuste lahjendamise ja näidete mõistmine
- Molaarsuse ja molaarsuse valemi mõistmine
- Lahenduste valmistamine
- Lahuse lahjendamine
- Molaarsusprobleemi näide
- Jaga seda:
- Seonduvad postitused:
Molaarsuse, valemite, valmistamise, lahuste lahjendamise ja näidete mõistmine
Arutleme molaarsuse üle hoolikalt.
Molaarsuse ja molaarsuse valemi mõistmine
Kontsentratsioon on lahustunud aine kogus või lahuse teatud kogus. Sel juhul võime eeldada, et aine on vedelas või tahkes olekus, samal ajal kui lahusti on vedeliku kujul. Kontsentratsiooni võib kirjeldada mitmel viisil, millest ühte kasutatakse tavaliselt ja tõepoolest kasutame tänapäeval molaarsust (M) või molaarset kontsentratsiooni. Molaarsus on igas liitri lahuses lahustunud moolide arv. Või seda saab seletada järgmise valemi abil:
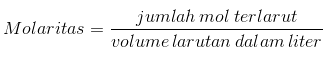
Lisaks saab seda väljendada ka järgmise valemiga: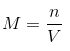 Kus n on lahustunud moolide arv ja V on lahuse maht igas liitris. Kui teada ei ole moolid, vaid lahustunud aine grammid, võib ülaltoodud valemit väljendada ka järgmiselt:
Kus n on lahustunud moolide arv ja V on lahuse maht igas liitris. Kui teada ei ole moolid, vaid lahustunud aine grammid, võib ülaltoodud valemit väljendada ka järgmiselt: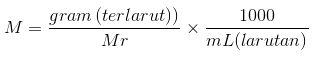
Veel üks asi, kui teada on lahuse tihedus (ρ) ja kontsentratsioon või massiprotsent (%), siis võib molaarsuse leida näites toodud valemi abil
1,46 molaarne glükoosilahus (C6H12O6) on kirjutatud kui 1,46 M C6H12O6, mis tähendab, et see sisaldab 1,46 mooli lahustunud ainet (C6H12O6) 1 liitris lahuses. Sel juhul ei pea maht olema 1 liiter, oluline on see, et suhe oleks sama. Näiteks kui lahuse maht on 500 ml (0,5 I), siis C6H12O6 lahustunud on 0,73 mooli.
Loe ka:Abaluu: määratlus, funktsioon, liikumine, kinnitatud lihased ja häired
Lahenduste valmistamine
Lahenduse tegemisel, mis muidugi on otseselt seotud molaarsusega. Seejärel tuleb kõigepealt kaaluda kõigepealt kaalutud lahustunud aine (tavaliselt tahke aine massiga grammides) lehtriga mõõtekolbi). Järgmise sammuna lisatakse mõõtekolbi aeglaselt veidi vett, et lahustunud aine lahustuks seda loksutades.
Kui lahustunud aine on täielikult lahustunud, on järgmine samm lisada vähehaaval vett ja ärge laske sellel mõõtekolvis piirjoont ületada.
Teades mõõtekolbi asetatava lahuse mahtu ja teades lahustunud aine kogust (sageli mõõdetud). grammides, nii et hiljem saab selle teisendada üheks mooliks valemiga mool = gramm / Mr), saab see arvutada lahuse molaarsuse seda.
Lahuse lahjendamine
Tavaliselt valmistatakse ja hoitakse lahuseid laboris kõrgetes kontsentratsioonides põhilahustena. See vähendab aega, võrreldes sellega, kui peaksime igas praktikumis lahenduse tegema. Seda "põhilahust" võetakse ainult vähe, mida seejärel lahjendatakse nii, et kontsentratsioon muutub väiksemaks ja vastavalt vajadustele. Seetõttu on vaja teada, kuidas lahust lahjendada.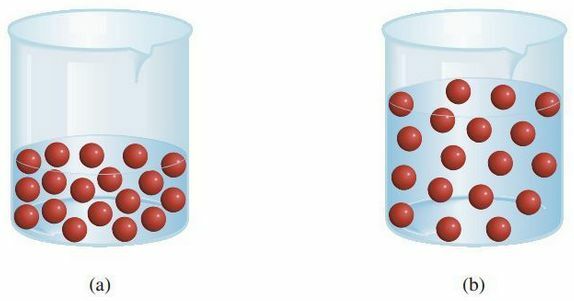
Lahjendamise korral ei muutu lahustunud aine moolide tegelik arv, muutub ainult maht. Järgige järgmise illustratsiooni selgitust
Kui enne lahjendamist on 18 lahustunud molekuli, siis vee lisamisel lahustunud molekulide arv ei muutu? See jääb ikkagi 18 molekuliks. Samuti ei muutu moolide arv, seega saab seda rakendada.
n enne lahjendamist = n pärast jaemüüki
Ja vastavalt eelmisele molaarsuse valemile, kus n = M.V, siis:
Loe ka:Kromosoomide, struktuuri, tüüpide, kujundite ja arvude määratlus
n1 = n2
M1 V1 = M2 V2
kus on M1 nimelt algkontsentratsioon enne lahjendamist ja M2 on lahuse kontsentratsioon pärast lahjendamist.
Molaarsusprobleemi näide
Järgnevalt on toodud näited molaarsuse rakendamise probleemidest, nimelt:
1. Kui suur on lahuse H maht2NII4 200 ml H lahuse valmistamiseks on vaja 2 M2NII4 0,5 miljonit?
Vastus:
M1 = 2M, V1 = …?
M2 = 0,5 M, V2 = 200 ml
Siis:
M1.V1 = M2.V2
2.V1 = 0,5.200
V1 = 50 ml
Seega on selle kohta selgitatud Molaarsuse, valemite, valmistamise, lahuste lahjendamise ja näidete mõistmineloodetavasti saab teie ülevaadet ja teadmisi täiendada. Täname külastamast ja ärge unustage teisi artikleid lugeda.

