Boyle'i seadus: definitsioon, valemid, rakendused, näiteülesanded
Boyle'i seadus: definitsioon, valemid, rakendused ja probleemide näited - Selles arutluses selgitame Boyle'i seadust. Mis hõlmab Boyle'i seaduse mõistmist, Boyle'i seaduse valemit, Boyle'i seaduse rakendamist ja näiteid Boyle'i seaduse küsimustest, mida arutatakse täielikult ja kergelt. Lisateabe saamiseks lugege palun hoolikalt allolevaid ülevaateid.
Sisukord
-
Boyle'i seadus: definitsioon, valemid, rakendused ja probleemide näited
- Boyle'i seaduse mõiste
- Boyle'i seaduse valem
- Boyle'i seaduse rakendamine
- Boyle'i seaduse näide
- Jaga seda:
- Seonduvad postitused:
Boyle'i seadus: definitsioon, valemid, rakendused ja probleemide näited
Arutame kõigepealt Boyle'i seaduse üle.
Boyle'i seaduse mõiste
Boyle'i seadus on üks füüsikaseadusi, mis arutleb, kuidas rõhu ja mahu suhe gaasis. Robert Boyle on Boyle'i seaduse avastaja aastal (1627-1691), ta viis läbi uuringu, et teada saada rõhu ja gaasi mahu suhet konstantsel temperatuuril. Oma uurimistööst leidis Robert Boyle, et suletud ruumis oleva gaasi rõhu ja mahu korrutis on konstantne.
Wikipedia andmetel on Boyle'i seaduse teine määratlus üks paljudest keemiaseadustest ja ideaalse keemiaseaduse erijuhtum. Kui temperatuur jääb suletud süsteemis konstantseks, kirjeldab Boyle'i seadus absoluutrõhu ja õhuhulga pöördvõrdelist suhet.
Robert Boyle avastatud Boyle'i seadus uurib rõhu mõju pideva temperatuuri gaasi mahule. Seda Robert Boyle'i avaldust nimetatakse Boyle'i seaduseks ja see kõlab:
"Konstantse temperatuuri korral on gaasi rõhk suletud ruumis pöördvõrdeline selle mahuga."
Igapäevaelus kohtame sageli Boyle'i seaduste kohaselt töötavate tööriistade näiteid, sealhulgas jalgrattapumbad, süstlad jms.

Boyle'i seaduse valem
Boyle'i seaduse järgi tähendab see, et suletud ruumis oleva gaasi rõhu ja mahu korrutis on konstantsel gaasi püsival temperatuuril.
Eespool toodud väide, kui see on kirjutatud valemis, nimelt:
P.V = C
Kus C on kindel arv (konstant). Kui rõhku muudetakse, muutub ka gaasi kogus, siis ülaltoodud valemi saab kirjutada järgmiselt:
P1. V1 = P2. V2
Loe ka:Inertsimoment: määratlus, tegurid, võrrandid objektide kujus ja probleeminäited
Tingimusel:
P1 = algne gaasirõhk (atm.cm Hg, N / m2, Pa)
P2 = lõplik gaasirõhk (atm, cm Hg, N / m2, Pa)
V1 = algne gaasimaht (m3, cm3)
V2 = gaasi lõplik maht (m3, cm3)
Boyle'i seadust kohaldatakse ainult siis, kui:
- Fikseeritud gaasi temperatuur või konstant
- Gaas on suletud ruumis
- Keemilist reaktsiooni pole
- Gaasilises olekus muutusi pole
Boyle'i seaduse rakendamine
Boyle'i seaduse rakendamine toimub pumba tööpõhimõttel. Pump on seade, mida kasutatakse gaasi / vedeliku transportimiseks. Selle tööpõhimõtte kohaselt on pump jagatud kaheks osaks, nimelt imemispumbaks ja survepumbaks.
Pärast sissehingamist suureneb pumba õhuhulk ja õhk ei pääse rehvi, kuna õhk peab sisenema kummist klapi (ventilatsiooniava) kaudu.
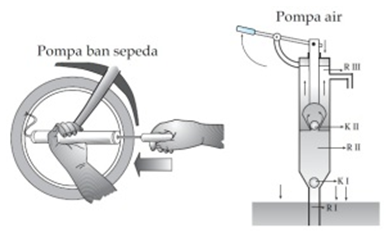
Sisselaskeava vajutamisel väheneb pumba õhuhulk ja rõhu tõusu tõttu võib õhk läbi ventilatsioonitoru tungida rehvi. Sarnased seadmed, mis kasutavad Boyle'i seadust, on süstlad, pipetid, survepumbad ja veepumbad.
Boyle'i seaduse näide
Järgmised näited Boyle'i seadusega seotud probleemidest:
1. Suletud kambris on gaas mahuga 200 ml. Kui ruumi rõhk on 60 cmHg, siis arvutage gaasi rõhk ruumis 150 ml mahuga?
Lahendus:
On tuntud:
V1 = 200 ml
P1 = 60 cmHg
V2 = 150 ml
Küsis: P2…?
Vastus:
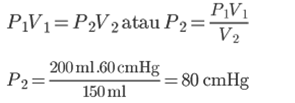
Boyle'i seaduse kohaselt on gaasi rõhk ruumis mahuga 250 ml 80 cmHG.
2. Suletud ruumis, mille maht on 0,2 m3, täidetud gaasiga, kui rõhku tõsta 80 000 Pa-ni?
Lahendus:
On tuntud:
P1 = 60 000 Pa
V1 = 0,2 m3
P2 = 80 000 Pa Küsitud: V2 ???
Vastus:
P1V1=P2 V2
V2 = (P1 V1): P2
V2 = (60 000 x 0,2): 80 000
V2 = 1,2/8
V2 = 0,15 m3. Seega muutub gaasi maht 0,15 M3
3. Boyle'i seaduse kohta, lk. V = k, k on mõõtmetega ...
A. Võimsus
B. Pingutus
C. Lineaarne hoog
D. Temperatuur
E. Kevadine konstant
Vastus: B
Arutelu:
On tuntud: V.p = k
Küsis: k = …?
Vastus:
lk. V = k
k = p. V = (m³)
k = Nm = Joule
Joule on tööühik. Niisiis, k-l on pingutuse mõõde.
4. Milline järgmistest tingimustest ei ole Boyle'i seaduse esinemise tingimus:
Loe ka:Kloonimine on: määratlus, tüübid, eelised ja näited
A. Fikseeritud temperatuur
B. Fikseeritud maht ja rõhk
C. Keemilist reaktsiooni ei toimu
D. Gaas suletud ruumis
E. Gaasi olek ei muutu
Vastus: B
Arutelu:
Boyle'i seadust kohaldatakse ainult teatud tingimustel, näiteks pideva gaasitemperatuuri, suletud ruumis oleva gaasi, keemiliste reaktsioonide ja gaasilise oleku muutuse puudumise korral.
5. Suletud anumas on gaas, mis paisub nii, et selle maht muutub 2 korda suuremaks kui algmaht (V = algmaht, P = algrõhk). Gaasi rõhk muutub ...
Arutelu
On tuntud :
Esialgne surve (P1) = P
Esialgne maht (V1) = V
Lõplik maht (V2) = 2V
Otsitakse: lõplik surve (P2)
Vastus:
P1 V1 = P2 V2
P V = P2 (2 V)
P = P2 (2)
P2 = P / 2 = P
Gaasi rõhk muutub algrõhu kordseks.
6. Suletud anumas on gaas, mille rõhk on 2 atm ja maht 1 liiter. Kui gaasi rõhk muutub 4 atm-ni, on gaasi maht ...
Arutelu
On tuntud :
Esialgne surve (P1) = 2 atm = 2 x 105 Pascal
Lõplik surve (P2) = 4 atm = 4 x 105 Pascal
Esialgne maht (V1) = 1 liiter = 1 dm3 = 1 x 10-3 m3
Otsitakse: Lõplik maht (V2)
Vastus:
P1 V1 = P2 V2
(2 x 105) (1 x 10-3) = (4 x 105) V2
(1) (1 x 10-3) = (2) V2
1 x 10-3 = (2) V2
V2 = x 10-3
V2 = 0,5 x 10-3 m3 = 0,5 dm3 = 0,5 liitrit
7. Suletud kamber sisaldab selles gaasi mahuga 200 ml. Mis siis, kui ruumi rõhk on 60 cmHg, arvutage siis gaasi rõhk ruumis, mille maht on 150 ml?
Lahendus:
On tuntud:
V1 = 200 ml
V2 = 150 ml
P1 = 60 cmHg
Küsis: P2 =…?
Vastus:
P1. V1 = P2. V2
60 cmHg. 20 ml = P2. 15 ml
P2 = 1200 cmHg / 15
P2 = 80 cmHg
Seega on selle kohta selgitatud Boyle'i seadus: definitsioon, valemid, rakendused ja probleemide näitedloodetavasti saab teie ülevaadet ja teadmisi täiendada. Täname külastamast ja ärge unustage teisi artikleid lugeda.
