Rutherford Atomi mõistmine, selle eelised ja puudused
Rutherfordi aatomi, tugevuste ja puuduste mõistmine - Sel puhul Teadmistest arutavad Rutherford Atomi üle. Mis seletab sel arutelul lühidalt ja selgelt Rutherfordi aatomi tähendust, teooriat, eeliseid ja puudusi. Lisateavet leiate järgmisest artiklist.
Sisukord
-
Rutherfordi aatomi, tugevuste ja puuduste mõistmine
- Atomi mõistmine
- Ernerst Rutherfordi aatomiteooria
-
Ernerst Rutherfordi aatomiteooria tugevused ja puudused.
- Ernerst Rutherfordi aatomiteooria
- Ernerst Rutherfordi aatomiteooria puudused
- Jaga seda:
- Seonduvad postitused:
Rutherfordi aatomi, tugevuste ja puuduste mõistmine
Aatomi elektronid võivad olla aatomituumaga seotud elektromagnetiliste jõudude abil. Selliste aatomite mitmest komplektist võivad nad omavahel ka suhelda ja moodustada ka molekuli.
Aatomid, mis sisaldavad sama arvu prootoneid ja elektrone, on neutraalsed, siis need, mis sisaldavad Erinevad prootonite või elektronide arvud on positiivsed või negatiivsed ning neid nimetatakse sageli ioonideks.
Need aatomid on rühmitatud ka aatomituumas sisalduvate prootonite ja neutronite arvu alusel. Prootonite arv aatomis määrab aatomi keemilise elemendi ja neutronite arv konkreetse elemendi isotoobi.
Atomi mõistmine
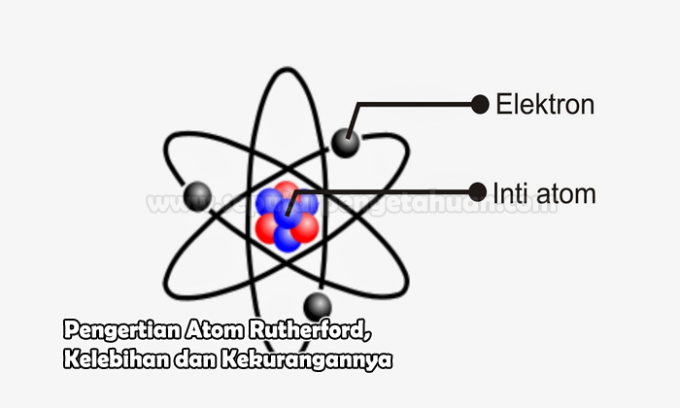
See aatom on aine põhiühik, mis koosneb aatomituumast ja teda ümbritsevast negatiivselt laetud elektronide pilvest. Selle aatomi tuum koosneb positiivselt laetud prootonitest või neutronitest, millel on neutraalne laeng.
Ernerst Rutherfordi aatomiteooria
Pärast seda, kui John Daltoni aatomiteooria oli ümber lükatud ja hiljem parandatud Jj. Thomson väitis, et aatom oli nagu rosinaleib. Siis oli Rutherfordi kord Thomsomi aatomiteooria tõde eitada.
Loe ka:Rändavad lained: määratlus, omadused, valemid ja näiteülesanded
Sel ajal ütles Rutherford, et aatomil on keskne tuum või seda nimetatakse sageli tuumaks, mida ümbritseb negatiivse laenguga elektronide pilv.
Rutherfordi aatomiteooria põhines alfaosakestel kuldplaadi aatomituuma pommitamise katsel, mida sageli nimetatakse Geiger-Marsdeni eksperimendiks. Sel ajal koostab Rutherford eksperimentaalse kavandi kulla aatomite pommitamiseks radioaktiivsete elementide eraldatud alfaosakeste poolt.
Selgub, et osa radioaktiivsetest kiirtest on peegeldunud, kõrvale kaldunud või ka edasi suunatud. Seejärel selgitas Rutherford, et kui alfaosake tabab aatomituuma. Siis toimub kokkupõrge, mis põhjustab alfaosakeste läbipainde või peegelduse. See on tingitud tuumasse koondunud aatomi massist ja laengust.
Seejärel soovitas Rutherford, et aatomituuma laeng oleks proportsionaalne aatomimassiga SMA / aatommassiühikutes. Elektroonipilve tabavad alfaosakesed ei paindu ega peegelda.
Nende katsete kaudu mõistmise tulemuste põhjal jõudis Ernerst Rutherford lõpuks järeldusele, et:
- Suurema osa aatomi mahust moodustab vaakum.
- Aatomimass koondub aatomituumas (tuumas).
- Aatomlaengu saab kontsentreerida aatomi keskmesse üsna väikese mahuga.
- Laengu mitmekordne on proportsionaalne aatommassiga.
Oma avalduse E abil. Rutherford võis eitada, et aatom ei olnud nagu rosinaleib. Pigem on see nagu päikese ümber tiirlevate planeetide paigutus. Kus päikest võrreldakse positiivselt laetud keskse südamiku (tuumaga) või planeetide paigutusega, mida kirjeldatakse negatiivse laenguna.
Seetõttu on Daltoni ja Thomsoni aatomiteoorial oma eelised ja puudused. Aatomiteooria E. Rutherfordil on oma tugevused ja nõrkused. Allpool on toodud aatomiteooria E eelised ja puudused. Rutherford.
Loe ka:Mõistmine temperatuuri mõõtevahenditest, funktsioonidest, liikidest ja töömeetoditest (täielik)
Ernerst Rutherfordi aatomiteooria tugevused ja puudused.
Ernerst Rutherfordi aatomiteooria eelised ja puudused on järgmised:
Ernerst Rutherfordi aatomiteooria
- Kergesti mõistetav, et oleks võimalik selgitada aatomi struktuuri, on väga keeruline.
- Oskab seletada aatomi tuuma ümber oleva orbiidi kuju.
- Oskab kirjeldada elektronide liikumist tuuma ümber.
Ernerst Rutherfordi aatomiteooria puudused
- Rutherfordi aatomimudel ei ole suutnud selgitada, kus elektronid asuvad ja kuidas neid nende aatomite ümber pööratakse.
- Need elektronid võivad liikumisel energiat eraldada, mistõttu aatomienergia muutub ebastabiilseks.
- Ei suuda seletada vesiniku aatomi (H) joone spektrit.
See on seletus Rutherfordi aatomi, tugevuste ja puuduste mõistmine. Loodetavasti võib see olla kasulik ja teie ülevaadet täiendada. Aitäh.
