Keemiline tasakaal: definitsioon, seadused, valemid, näidisülesanded
Keemiline tasakaal: definitsioon, seadused, valemid, näidisülesanded - Selles arutelus selgitame keemilise tasakaalu, valemi seaduse ja oleme varustatud täieliku ja valguse keemilise tasakaalu näidetega. Lisateabe saamiseks lugege palun hoolikalt allolevaid ülevaateid.
Sisukord
-
Keemiline tasakaal: definitsioon, seadused, valemid, näidisülesanded
- Keemilise tasakaalu mõistmine
-
Tasakaaluseisundi omadused
- Keemiline tasakaalunihe
- Aine kontsentratsiooni mõju keemilisele tasakaalule
- Rõhu ja mahu mõju keemilisele tasakaalule
- Temperatuuri mõju keemilisele tasakaalule
- Keemilise tasakaalu seadus
-
Keemilise tasakaalu üldvalem
- Heterogeenne tasakaal
- Homogeenne tasakaal
- Keemilise tasakaalu pinnase näide
- Osaline tasakaalukonstant
- Osalise rõhu tasakaalu suhe tasakaalukonstandiga
- Jaga seda:
- Seonduvad postitused:
Keemiline tasakaal: definitsioon, seadused, valemid, näidisülesanded
Arutagem kõigepealt hoolikalt keemilise tasakaalu tähendust.
Keemilise tasakaalu mõistmine
Keemiline tasakaal on pöörduv reaktsioon, mille käigus reagentide ja saaduste kiirused on ühesugused ja nende kontsentratsioonid konstantsed. Keemiline tasakaal tekib ainult pöörduval reaktsioonil, mille korral reagentide moodustumise kiirus on sama, mis saaduste moodustumise kiirus.
Keemiline tasakaal on dünaamiline, seetõttu nimetatakse seda sageli dünaamiliseks tasakaaluks. Dünaamiline tasakaal on vahelduv reaktsioon, kui kontsentratsioonitingimused on konstantsed, kuid tegelikult toimub reaktsioon pidevalt. Dünaamiline tasakaal ei toimu makroskoopiliselt, vaid toimub mikroskoopiliselt (aineosakesed).
Keemiline tasakaal tekib ainult pöörduval reaktsioonil, kus reaktiivide moodustumise kiirus on võrdne toodete moodustumise kiirusega. Reaktsioon toimub mikroskoopiliselt pidevalt, nii et seda võib nimetada dünaamiliseks tasakaaluks.
Tasakaaluseisundi omadused
Tasakaaluseisundi omadused on järgmised:
- Esineb suletud anumas, püsiva temperatuuri ja rõhu all
- Reageerijatele reageerimise kiirus on sama kui saadustele reageerimise kiirus
- Reaktsioon kulgeb pidevalt (dünaamiliselt) kahes vastassuunas
- Väga mikroskoopiline esinemine aineosakeste partikeli tasemel
- Toodete ja reagentide kontsentratsioon jääb alles
Keemiline tasakaalunihe
Keemilist tasakaalu mõjutavad mitmed tegurid, sealhulgas ainete kontsentratsioon, temperatuur ning rõhk või maht.
Aine kontsentratsiooni mõju keemilisele tasakaalule
Ühe aine kontsentratsiooni suurendamisel nihkub reaktsiooni tasakaal aine (mille kontsentratsioon lisatakse) suunas (eemale). Kui ühe aine kontsentratsiooni vähendatakse, nihkub tasakaal aine vähendatud kontsentratsiooni suunas.
Näide: Järgmises reaktsioonivõrrandis
N2 (g) + 3H2 (g) <==> 2NH3 (g) H = -92 kJ.
Kui N2 kontsentratsiooni suurendatakse, nihkub tasakaalureaktsioon paremale, sest aine kontsentratsiooni suurendamisel nihkub tasakaalureaktsioon lisatud kontsentratsiooni suunast.
Kui N2 kontsentratsiooni vähendatakse, nihkub tasakaalureaktsioon vasakule, sest kui aine kontsentratsiooni vähendatakse, nihkub tasakaalureaktsioon vähendatud kontsentratsiooni suunast.
Loe ka:Analüütilise keemia, tüüpide ja meetodite mõistmine (täielik)
Rõhu ja mahu mõju keemilisele tasakaalule
Kui rõhku süsteemis suurendatakse või mahtu vähendatakse, nihkub reaktsiooni tasakaal väiksema arvu molekulide suunas.
Kui rõhku süsteemis vähendatakse või mahtu suurendatakse, nihkub tasakaal väiksema arvu molekulide suunas.
"rõhk ja maht on pöördvõrdelised"
Näide: Järgmises reaktsioonivõrrandis
N2 (g) + 3H2 (g) <==> 2NH3 (g) H = -92 kJ
Reagentide moolide arv = 1 + 3 = 4
Toote moolide arv = 2
Kui rõhku süsteemis suurendatakse, nihkub tasakaalureaktsioon paremale, sest kui Rõhu suurendamisel nihkub reaktsiooni tasakaal kõige väiksema arvu molekulide suunas st 2.
Kui süsteemi mahtu vähendatakse, nihkub tasakaal paremale, sest kui Kui süsteemi mahtu vähendatakse, nihkub tasakaalureaktsioon väiksemate molekulide suunas st 2.
Kui süsteemis rõhku vähendatakse, nihkub tasakaalureaktsioon vasakule, sest rõhu suurendamisel. Seega nihkub tasakaalureaktsioon suurema arvu molekulide suunas, mis on 4.
Kui rõhku süsteemis suurendatakse, nihkub reaktsiooni tasakaal vasakule, sest kui süsteemi mahtu suurendada. Niisiis nihkub reaktsiooni tasakaal suurema hulga molekulide suunas, mis on 4.
Temperatuuri mõju keemilisele tasakaalule
Kui süsteemi temperatuuri tõstetakse, liigub tasakaalureaktsioon soojust või endormi eraldava aine suunas.
Kui süsteemi temperatuuri alandatakse, liigub tasakaalureaktsioon soojust eraldava või eksotermilise aine suunas.
Näide: reaktsioonivõrrandis
[A] + [B] <==> [C] H = -X
[C] on eksotermiline reaktsioon (eraldab soojust ja [A] + [B] on endotermiline reaktsioon (vajab soojust)
Kui temperatuuri tõstetakse, liigub tasakaalureaktsioon vasakule, sest kui temperatuur Kui süsteemi suurendatakse, nihkub tasakaalureaktsioon soojust nõudva reaktsiooni suunas või endotermiline.
Kui temperatuuri alandatakse, liigub tasakaalureaktsioon paremale, sest kui temperatuur Kui süsteem on üles tõstetud, nihkub tasakaalureaktsioon soojust nõudva reaktsiooni suunas või endotermiline.
Kui temperatuuri langetatakse, siis liigub tasakaalureaktsioon paremale, sest kui Kui süsteemi temperatuuri tõstetakse, nihkub reaktsiooni tasakaal soojust eraldavas suunas eksotermiline.
Keemilise tasakaalu seadus
Keemilise tasakaalu seadus ehk tasakaalukonstant on toote kontsentratsioonide suhe iga reaktiivkontsentratsiooni koefitsientide võimsusse nende vastavate koefitsientide võimsusse. Tasakaalukonstandi saab sümboliseerida K või Kc.
Loe ka:Lisandid * f: määratlus, olemus, liigid ja mõjud
Keemilise tasakaalu üldvalem
Keemilise tasakaalu võrrand või valem on järgmine: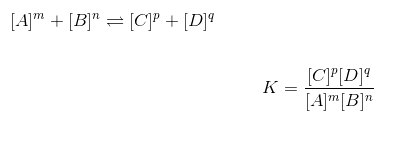
Heterogeenne tasakaal
Selle heterogeense tasakaalu reaktsioonides osalevate ainete vormid on erinevad, nii et see võetakse sisse tasakaalukonstandi määramine on aine kontsentratsioon, mille tasakaalukonstant mõjutab ja gaasid.
Homogeenne tasakaal
Selles homogeenses tasakaalus on reaktsioonis osalevate ainete kuju sama, seega tasakaalukonstandi määramiseks kasutatavate ainete kõik kontsentratsioonid. Kuid tuleb meeles pidada, et tasakaalukonstandi mõju avaldub ainult gaaside ja lahuste kujul.
Keemilise tasakaalu pinnase näide
Arvestades tasakaalureaktsiooni
2A + B <==> A2B
Esialgu on 2-liitrises anumas 2 mooli A ja 2 mooli B, kui tasakaalus 0,5 mooli A, siis milline on tasakaalu konstant?
Vastus:
Eespool toodud väite põhjal saab moolide arvu määrata järgmiselt: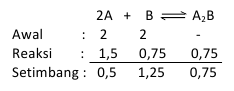
Siis: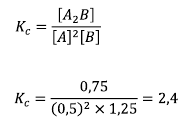
Probleemi maht mõjutab, kuna see kõrvaldab üksteise.
Osaline tasakaalukonstant
Osalise tasakaalu konstant on toodete osarõhkude korrutise suhe nende vastavate koefitsientide võimsusse koos reaktantide osarõhkudega nende vastavate koefitsientide võimsusse. Osalise tasakaalu konstanti saab sümboliseerida Kp-ga.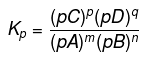
Teave
P = osaline rõhk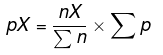
Teave:
pX = osaline rõhk leidmiseks
nX = aine moolid, mille osaline rõhk on leitav
En = süsteemi moolid kokku
Ep = süsteemi kogurõhk
Probleemide näide:
Kokku kuumutatakse N2 ja H2 moodustamiseks 6 mooli NH3. Tasakaalu saavutamisel jääb järele 2 mooli NH3, kui gaasisegu kogurõhk on 10 atm, määrake Kp väärtus.
Vastus:
Ülaltoodud küsimusest võime saada järgmised andmed: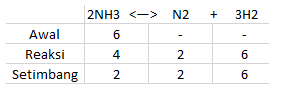
Moolid süsteemis kokku: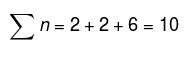
Leidke iga aine osarõhk võrrandiga: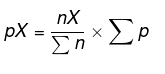
Seega saame pBH3 = 2 atm, pN2 = 2 atm ja pH2 = 6atm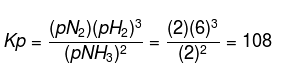

Osalise rõhu tasakaalu suhe tasakaalukonstandiga
Seda seost saab väljendada järgmise võrrandiga: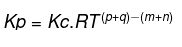
Teave:
R = gaasikonstant
T = temperatuur
p, q, m ja n = reageerivate ainete koefitsiendid
Dissotsiatsiooni aste
Dissotsiatsiooni aste on väärtus, mida kasutatakse aine eraldatud osade määramiseks. Dissotsiatsiooni astme võrrand on: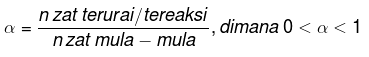
Tasakaalukonstandi tähendus
Tasakaalukonstandit saab kasutada mitme funktsiooni jaoks, sealhulgas:
- Annab vihjeid tasakaalu positsiooni kohta
- Reaktsiooni suuna hindamine
Seega on selle kohta selgitatud Keemiline tasakaal: definitsioon, seadused, valemid, näidisülesandedloodetavasti saab teie ülevaadet ja teadmisi täiendada. Täname külastamast ja ärge unustage teisi artikleid lugeda.
