Elektrolüüsi rakkude, tüüpide, reaktsioonide, osade ja näidete mõistmine
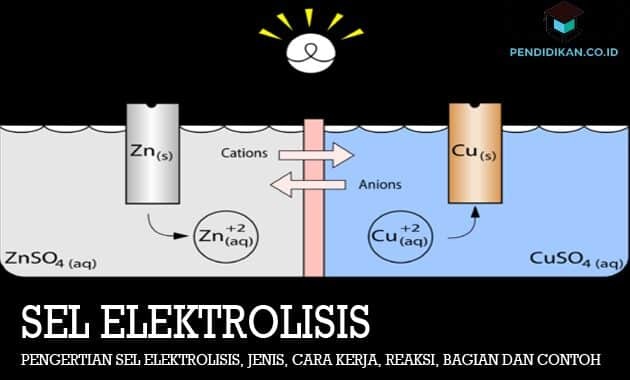
Mis on elektrolüüsirakk
See elektrolüütiline element on elektrokeemiline element, milles redoksreaktsiooni läbiviimiseks kasutatav elektrienergia ei ole spontaanne. Elektrolüüsireaktsiooni võib määratleda ainete lagunemisreaktsioonina, kasutades elektrivoolu. Elektrolüüsielemendi tööpõhimõte on ühendada vooluallika negatiivne poolus katoodi suunas ja ka positiivne poolus anoodile nii, et tekib ülipotentsiaal, mis põhjustab redutseerimis- ja oksüdatsioonireaktsiooni, mis ei ole spontaanne või võib toimuda. Elektronid voolavad katoodist anoodi. Positiivseid ioone kipub katood meelitama ja nad ka vähenevad, samas kui negatiivsed ioonid kalduvad anoodile ja oksüdeeruvad.
Elektrolüüsi rakkude paigutus
Üldiselt koosneb see elektrolüütiline element:
- Toiteallikas, mis varustab alalisvoolu (alalisvoolu), näiteks aku.
- Anood on elektrood, kus toimub oksüdatsioonireaktsioon.
- Katood on elektrood, kus toimub reduktsioonireaktsioon.
- Elektrolüüdid on ained, mis suudavad elektrit juhtida.
Ülaltoodud pildil näete sulatatud NaCl elektrolüüsielemendi vooluahelat. Elektrolüütiline rakk ei vaja soolasilda, nagu see on Voltaici elemendi puhul. Kasutatav elektrood võib olla või mitte olla inertne elektrood nagu plaatina või grafiit, mis ei ole rakus oksüdeerunud ega redutseeritud.
See elektrolüüsiprotsess algab elektrivooluga, mis voolab pingeallikast samas suunas. Negatiivse pooluse elektronid voolavad katoodi suunas. Selle tulemusel meelitatakse sulatatud NaCl positiivsed Na + ioonid katoodi külge ja neelavad seejärel neutraalseks Na-ks redutseeritavad elektronid. Vahepeal tõmbavad sulas olevad negatiivsed Cl− ioonid positiivse pooluse anoodi külge. Cl− ioonid oksüdeeritakse elektronide vabastamise teel neutraalseks Cl2 gaasiks. Seejärel voolatakse elektronid anoodi ja edastatakse pingeallika positiivsesse poolusesse. Niisiis, redoksreaktsiooni, mis toimub sulanud NaCl elektrolüüsikambris, saab kirjutada järgmiselt.
- Katood (reduktsioon) = Na + (l) + e− → Na (l)
- Anood (oksüdeerumine) = 2Cl− (l) → Cl2 (g) + 2e−
- Rakureaktsioon (redoks) = 2Na + (l) + 2Cl− (l) → 2Na (l) + Cl2 (g)
Elektrolüüsielemendi osa
Elektrolüüsikambris on mitu vooluahela osa, mis peavad selle elektrokeemilise sündmuse või esinemise korral loomulikult olema täidetud. Elektrolüüsikambri põhiosad sisaldavad järgmist;
Elektrood

See elektrood on juht, mis suudab või suudab juhtida elektrivoolu, mis elektrolüüsikambris on elektrood jagatud kahte tüüpi, sealhulgas anood ja katood.
Elektrolüüsiprotsessis on igal anoodil oma funktsioon, mis on nagu anoodil toimib nii oksüdatsioonireaktsioonide kui ka katoodina, mis toimib reaktsioonide toimumise kohana vähendamine. Mõlemad reaktsioonid täiendavad üksteist ja toimuvad alati samaaegselt.
Nende elektroodide valikut saab näha redutseerimispotentsiaali väärtusest, mis on kohandatud reageeriva ainega. Põhimõtteliselt on valitud elektrood inertse olemusega või ei reageeri lahusele ega ka sellele nii kasutatavatel reagentidel kui ka nendel elektroodidel on aktiivsed omadused, mis võivad või võivad reageerida lahendus.
Sageli kasutatavate inertsete elektroodide näited hõlmavad plaatina ja süsinikku, samas kui aktiivsete elektroodide hulka kuuluvad sageli vask ja nikkel.
Elektrolüüt
See elektrolüüt on lahendus, mis on võimeline juhtima elektrit või millel on ka kõrge elektrijuhtivus. Põhimõtteliselt on elektrolüüdi lahus ioonid lahustanud üsna suures kontsentratsioonis nii et sellest tulenevalt on ioonide liikumisel lahuses roll omadustes selle juhtivus.
Elektrolüüdi lahuses olevad ioonid reageerivad ja saavad hea reaktsiooni reduktsioon või oksüdeerumine, mis toimub elektroodi sees, nimelt elektrivoolu juuresolekul, mis vastamata. Elektrolüüdilahuste näideteks on CuSO4 ja NaCl.
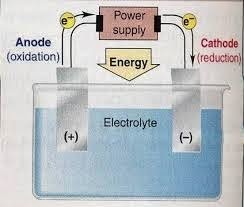
Elektrivoolu allikas
See elektrivooluallikas on väga oluline ka redutseerimis- ja oksüdatsioonireaktsioonide tekkimiseks. Elektrivool võib olla otsese elektri (DC) kujul, mis voolab läbi kahe vastupidise laenguga elektroodi elektrolüüdilahusesse.
Selle elektrivoolu olemasolu põhjustab kindlasti elektronide liikumise anoodilt katoodile, mis põhjustab reaktsiooni anoodil oksüdatsiooni olekus ja katoodi reduktsiooni. Ilma elektrivooluta seda redutseerimis- ja oksüdatsioonireaktsiooni ei toimu, kuna süsteemis pole elektroni ülekannet.
Elektrolüüsirakkude tüübid
Neid elektrolüütilisi rakke saab klassifitseerida elektrolüüdilahuse tüübi või kasutatud elektroodide järgi. allpool on toodud elektrolüütiliste rakkude tüübid;
Sulanud / sulanud elektrolüüsikamber
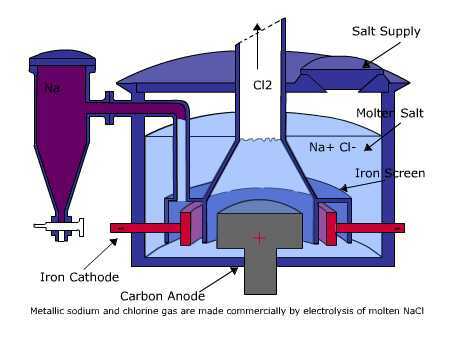
See elektrolüüsikamber on elektrolüüdisüsteem koos elektrolüüdiga aine sulamise või sulandumise kujul veelahusti puudumisel.
Seda tüüpi elektrolüütides on ainult H2O molekulita katioonid ja anioonid. Ka seda tüüpi elektrolüüsi korral katioon katoodis väheneb, samas kui aniooni korral oksüdeeritakse see otse anoodis. Seda tüüpi elektrolüüsi näide on sulatatud NaCl kasutamine.
Lahuse elektrolüüsirakk
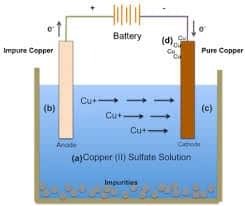
See tüüp on vastupidine eelmisele tüübile, kus kasutatav elektrolüüt on lahuse kujul, mille lahusti on vesi. See tähendab, et elektrolüüdis on anioon, katioon ja ka H2O molekul nii et vee olemasolu tõttu võetakse arvesse ka seda, et reaktsiooni ajal tekib konkurents aset leidma.
Selle lahuse elektrolüüs jaguneb samuti kahte tüüpi, nimelt lahuse elektrolüüs koos inertsete ja aktiivsete elektroodidega. Selle elektrolüüsielemendi näiteks on kasutada CuSO4 elektrolüüdilahust.
Kuidas elektrolüüsirakud töötavad
Elektrolüüsikambris, mis on kokku pandud või on kokku pandud 3 täieliku põhikomponendiga, saab seejärel raku käivitada nii, nagu peaks. Selle elektrolüüsielemendi tööpõhimõte on see, kui elektrivool voolab kambri sisse elektroodi, siis anoodi juures antakse sellele positiivne laeng ja katoodi jaoks laetakse seda negatiivne.
Siis toimub elektrivoolu tagajärjel elektronide liikumine, elektronid liiguvad anoodilt katoodile. Selle tulemusena jääb anoodis puudu elektronidest, nii et anood tõmbaks seejärel lahusest elektrone Elektrolüüdid, mis sisaldavad anioone, millel on negatiivne laeng ja mis kaotamise kaudu läbivad ka oksüdatsioonireaktsiooni elektron.
Selles katoodis on palju negatiivset laengut, nii et selle neutraliseerimiseks on vaja positiivset laengut Seetõttu kipub see katood elektrolüüdis katioone ligi tõmbama, nii et katioonid vähenevad aktsepteerimisega elektron.
Elektrolüüsireaktsioon
Üldiselt hõlmab sulatatud ioonühendite elektrolüüs lihtsamaid redoksreaktsioone. Seda seetõttu, et vee puudumisel katoodid katoodis vähenevad ja anioonid oksüdeeritakse anoodi juures. Näiteks sulatatud MgBr2 elektrolüüsil redutseeritakse Mg2 + ioonid katoodil Mg metalli moodustamiseks ja ka Br-ioonid oksüdeeritakse anoodi juures, moodustades gaasi Br2.
Kui elektrolüüsireaktsioon toimub lahusesüsteemis, on aga mitu konkureerivat redoksreaktsiooni, nii et sellest tulenevalt kipuvad reaktsioonid olema üsna keerukad. Mõned tegurid, mis määravad selle elektrolüüdilahuse elektrolüüsireaktsiooni, hõlmavad järgmist.
1. Seansid elektrolüüdi lahuses
See vähendatud liik on liik, millel on positiivsem redutseerimispotentsiaal
see oksüdeerunud liik on liik, millel on rohkem negatiivset redutseerimispotentsiaali (rohkem positiivset oksüdatsioonipotentsiaali)
2. Inertse või aktiivse elektroodimaterjali olemus
See inertelektrood on elektrood, mis ei osale elektrolüüsi redoksreaktsioonis. Näited on näiteks: plaatina (Pt), kuld (Au) ja grafiit (C).
See aktiivne elektrood on elektrood, mis võib või võib osaleda elektrolüütilises redoksreaktsioonis. Näited on näiteks: vask (Cu), kroom (Cr) ja nikkel (Ni).
3. Antud täiendav potentsiaal (ülipotentsiaal)
Ülevõimsust on vaja selleks, et oleks võimalik ületada elektroodi pinnal toimuvat vastasmõju, mis tekib tavaliselt siis, kui elektrolüüs tekitab gaasi.
Elektroodipotentsiaali standardandmete põhjal saab järgmiseid sätteid järgides ennustada elektrolüüdilahuse elektrolüüsi reaktsiooni standardsetes tingimustes.
Näiteks võime täheldada erinevust nii grafiitelektroodiga kui ka järgneval hõbedase (Ag) elektroodiga AgNO3 lahuse elektrolüüsil.
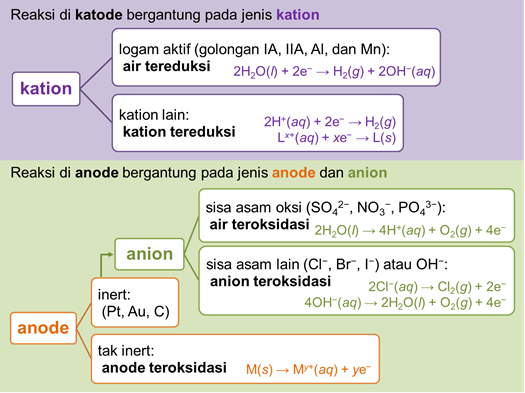
a. AgNO3 lahuse elektrolüüs grafiidelektroodiga
Katoodi juures on selle redutseerimise liik Ag +. Seda seetõttu, et Ag ei ole aktiivne metall, mille redutseerimispotentsiaal on negatiivsem kui vee redutseerimispotentsiaal.
Katood: Ag + (aq) + e− → Ag (s)
Anoodi juures on grafiidelektrood inertne elektrood, nii et see ei oksüdeeru. See NO3-liik on oksihappe jääk, mida on raske oksüdeerida, mille tulemusel vesi oksüdeerub.
Anood: 2H2O (l) → 4H + (aq) + O2 (g) + 4e−
b. AgNO3 lahuse elektrolüüs hõbedase elektroodiga
Katoodi juures on redutseeritav liik Ag +. Katoodi redutseeritud liigid ei sõltu kasutatud elektroodist, vaid ainult katiooni tüübist elektrolüüdi lahuses.
Katood: Ag + (aq) + e− → Ag (s)
Anoodi juures ei ole Ag elektrood inertne elektrood, seega oksüdeeritakse.
Anood: Ag (s) → Ag + (aq) + e−
Näited elektrolüüsirakkude probleemidest ja arutelu
Kirjutage allpool elektrolüüsireaktsioon.
a. CuSO4 lahuse elektrolüüs vaseelektroodidega
b. KI lahuse elektrolüüs grafiitelektroodiga
c. sulanud CaCl2 elektrolüüs plaatinaelektroodidega
Vastus:
- CuSO4 (aq) → Cu2 + (aq) + SO42− (aq)
See Cu ei ole aktiivne metall, seega väheneb katoodil Cu2 + katioon. Seetõttu ei ole vask (Cu) elektrood inertne elektrood, seega oksüdeeritakse Cu anood.
Katood: Cu2 + (aq) + 2e− → Cu (s)
Anood: Cu (s) → Cu2 + (aq) + 2e−
Rakureaktsioon: Cu (s) anood → Cu (s) katood
- KI (aq) → K + (aq) + I− (aq)
See K on aktiivne metall, nii et sellest katoodis väheneb vesi. Seetõttu sisaldab see grafiitelektrood inertset elektroodi ja I-anioon ei sisalda ülejäänud oksihapet, seetõttu I-anioon oksüdeeritakse anoodil.
Katood: 2H2O (l) + 2e− → H2 (g) + 2OH− (vesilahus)
Anood: 2I− (aq) → I2 (g) + 2e−
Rakureaktsioon: 2H2O (l) + 2I− (aq) → H2 (g) + 2OH− (aq) + I2 (g)
- CaCl2 (l) → Ca2 + (l) + 2Cl− (l)
Sulanud ioonühendi CaCl2 elektrolüüsiks plaatinaelektroodiga (see hõlmab ka: inertelektrood), katoodis väheneb Ca2 + katioon ja oksüdeeritakse Cl-anioon anoodi juures.
Katood: Ca2 + (l) + 2e− → Ca (d)
Anood: 2Cl− (l) → Cl2 (g) + 2e−
Rakureaktsioon: Ca2 + (l) + 2Cl− (l) → Ca (s) + Cl2 (g)
Sellega selgitatakse elektrolüütiliste rakkude määratlust, tüüpe, kuidas see töötab, reaktsioone, osi ja näiteid. Loodetavasti võib kirjeldatu teile kasulik olla. aitäh
Vaata kaAnabolismi mõiste
Vaata kaStartupide mõistmine
Vaata kaPoliitilise kultuuri mõistmine, omadused ja tüübid üldiselt ekspertide sõnul
