Termodünaamika määratlus, põhimõtted, mõisted, valemid, seadused, näited

Termodünaamika määratlus
See termodünaamika määratlus on teadus, mis kirjeldab / illustreerib jõupingutusi soojuse muutmisel (s.t. temperatuuri erinevusest põhjustatud energia ülekandmine energiasse ja ka temperatuuri erinevused tema toetajad. Termodünaamika on tihedalt seotud energia, töö, soojuse, entroopia ja ka protsesside spontaansusega.
Peale selle on termodünaamika seotud ka staatilise mehaanikaga. Seejärel uurib see füüsika haru energia vahetust soojuse ja töö vormis, piirates süsteeme ja keskkonda. Selle termodünaamika rakendamine ja rakendamine võib seejärel toimuda inimkehas, näiteks kuuma kohvi puhumise või esinemise korral, Külmikud, elektroonikaseadmed, autod, elektrijaamad ja tööstus on need kõige levinumad termodünaamilised sündmused, millega elu kokku puutub iga päev.
Termodünaamika põhimõtted
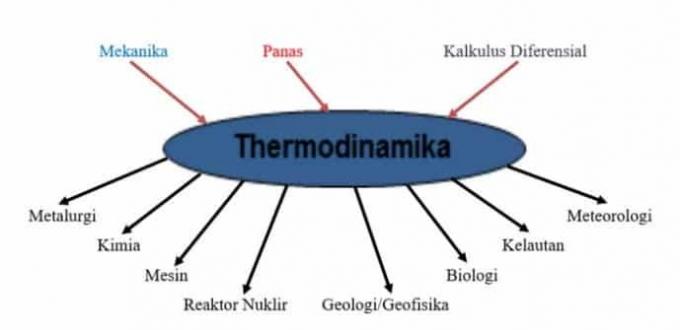
Termodünaamika põhimõtete rakendamiseks, mis hõlmavad mehaanikat, soojust ja diferentsiaalkalkulatsiooni teistes teadustes, on näidatud käesoleval joonisel.
Järgmine pilt näitab, et termodünaamika probleemi / probleemi lahendamine toimub mitmel etapil, sealhulgas:
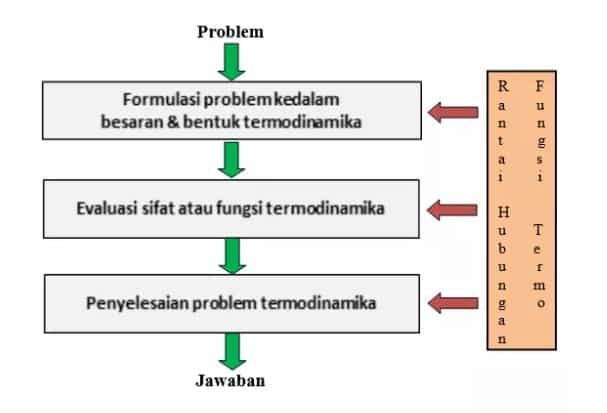
Probleemi sõnastamine termodünaamilisteks suurusteks ja vormideks. Seda öeldakse siis, muutes probleemi keele termodünaamika keeleks, seejärel sõnastades selle termodünaamiliste suuruste abil.
Termodünaamiliste omaduste ja funktsioonide hindamine tähendab see esimeses etapis valmistatud või valmistatud koostise analüüsi läbiviimist (1). See etapp nõuab siis termodünaamiliste teadmiste adekvaatset mõistmist, et probleemi suunda või eesmärki ei eksitataks.
Termodünaamiliste probleemide lahendamine. Selles etapis on vaja tuge matemaatilistele / arvutuslikele teadmistele (diferentsiaal, integraal), et saada kehtivaid või vastutustundlikke vastuseid.
Need kolm termodünaamika lahendamise etappi peavad siis põhinema postulaatidel või ka termodünaamika reeglitel.
Sisuliselt on see termodünaamika põhimõte tegelikult loomulik asi, mis juhtub igapäevaelus. Teaduse ja tehnoloogia arenguga on siis termodünaamika sellisel viisil konstrueeritud sellisel viisil, et siis saab sellest mehhanismi vorm, mis võib inimesi aidata või aidata oma tegevust. Nii laialdane termodünaamika rakendamine on võimalik, kuna termodünaamikateadus on arenenud alates 17. sajandist. Termodünaamika teaduse areng algab seejärel makroskoopilise lähenemisviisiga, nimelt aineosakeste üldise käitumisega, mis seejärel muutuvad energiakandjateks.
Termodünaamiline protsess
Termodünaamiline protsess jaguneb nelja tüüpi, sõltuvalt rõhu, mahu ja temperatuuri olekust protsessi toimumise ajal. Seda protsessi on tavaliselt kujutatud P-V diagrammil, mis on diagramm, mis kirjeldab protsessi tekkimisel rõhku (P) ja mahtu (V). Igat tüüpi termodünaamiliste protsesside puhul tuleb meeles pidada kahte olulist asja, nimelt muutujaid ja tehtud tööd. Termodünaamilises protsessis toimuvat tööd saab või saab teada arvutades P-V graafiku pindala.
Isobaarne protsess
See isobaarne on termodünaamiline protsess, mis ei muuda süsteemi rõhu väärtust 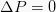
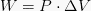
Selle valemi järgi on ka teada, et kui maht suureneb (paisumine toimub), siis siis on äri positiivne ja ka siis, kui maht väheneb (tekib amortisatsioon), on äri väärt negatiivne.

Isohoorne protsess
See isokoorne on termodünaamiline protsess, mis ei muuda süsteemi mahu väärtust 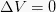

Isotermiline protsess
See isoterm on termodünaamiline protsess, mis ei muuda süsteemi temperatuuri väärtust 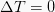
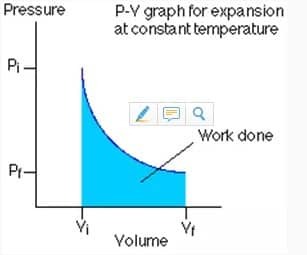
Isotermiliselt töödeldud töö väärtus on väljendatud järgmise võrrandi abil:
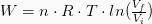
Kui n on aine kogus moolides, R on gaasikonstant ja T jaoks temperatuur. Valem saadakse P-V diagrammil oleva töövalemi ühendamisel ideaalse gaasivõrrandiga.
Adibaatiline protsess
Adiabaatiline on termodünaamiline protsess, mis ei muuda süsteemi kütteväärtust (Q = 0).

Monatoomilises gaasis saab adiabaatilises protsessis tehtud tööd väljendada võrrandiga:
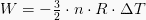
Lühidalt on nendel adiabaatilistel ja isotermilistel protsessidel sarnased P-V diagrammid. Üksikasjalikult on näha, et adiabaatilisel protsessil on järsem kalle kui isotermilisel protsessil, nagu on näidatud järgmises graafilises näites.

Kui kogu protsessi kirjeldatakse P-V diagrammina, võib saada järgmise graafiku. Tuleb meeles pidada, et arvutustes kasutatud ühikud on rahvusvahelised ühikud. Näiteks on kasutatava temperatuuri ühik Kelvin, mahuühik on m3 ja aine koguse ühik on moolid.
Termodünaamiline süsteem
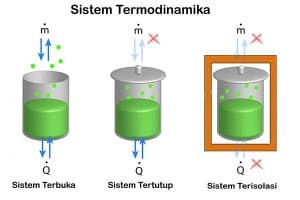
See termodünaamiline süsteem on osa universumist, mis loeb. Reaalne või väljamõeldud piir eraldab süsteemi universumist, mida nimetatakse keskkonnaks. Termodünaamiliste süsteemide klassifitseerimine, lähtudes süsteemi-keskkonna piiri olemusest ning aine, soojuse ja entroopia ülekandest süsteemi ja ümbruse vahel.
Süsteemi ja keskkonna vahel toimuva vahetuse tüübi põhjal on kolme tüüpi süsteeme:
Suletud süsteem
Toimub energiavahetus (soojus ja töö), kuid esemeid keskkonnaga ei toimu. Roheline maja on näide suletud süsteemist, kus toimub soojusvahetus, kuid keskkonnaga ei toimu töövahetust. Seda, kas süsteem vahetab soojust, tööd või mõlemat, peetakse tavaliselt selle piiravaks omaduseks:
- Adiabaatiline barjäär: ei võimalda soojusvahetust
- Jäik tõke: ei võimalda töövahetust.
Isoleeritud süsteem
Ei toimu soojuse, aine vahetust ega tööd keskkonnaga. Selle isoleeritud süsteemi näiteks on isoleeritud mahuti, näiteks isoleeritud gaasiballoonis.
Avatud süsteem
Toimub energia (soojus ja töö) ja esemete vahetus nende keskkonnaga. Takistust, mis seejärel võimaldab esemeid vahetada, nimetatakse läbilaskvaks. See ookean on avatud süsteemi näide.
Tegelikkuses ei saa ega saa süsteemi keskkonnast täielikult isoleerida sest mingisugust segamist peab toimuma, isegi kui see on vaid kerge tagasivõtmine raskusjõud. Eraldatud süsteemianalüüsis on süsteemi sisenev energia sama kui süsteemist väljuv energia.
Termodünaamiline olek
Kui süsteem on antud olekus tasakaalus, nimetatakse seda kindlaks olekuks (või ka süsteemi olekuks).
Antud termodünaamilise oleku või olukorra jaoks on süsteemi paljud omadused määratud. Omadust, mis on sõltumatu teest, mida mööda süsteem moodustab riigi, nimetatakse süsteemi olekufunktsiooniks. Seejärel käsitletakse selle jaotise järgmises jaotises ainult omadusi, mis on olekufunktsioonid.
Minimaalsete omaduste arv, mis tuleb seejärel konkreetse süsteemi olukorra või oleku kirjeldamiseks täpsustada, määratakse Gibbsi faasiseadusega. Tavaliselt seisab see inimene silmitsi süsteemi omadusega, mis on suurem kui see minimaalne summa.
Võimalik on seoste kujunemine erinevate asjaolude omaduste vahel. See olekuvõrrand on sellise suhte näide.
Termodünaamika põhiseadused

Termodünaamilises süsteemis kehtivad 4 põhiseadust, sealhulgas järgmised:
Termodünaamika Zerothi seadus
Esialgne seadus ütleb, et kaks süsteemi on tasakaalus, s.t kolmanda süsteemiga, siis on kõik kolm omavahel tasakaalus. Seadus sisestatakse pärast esimest seadust.
Esimene termodünaamika seadus
Sama seadus kehtib ka energia säästmise puhul. Seejärel ütleb seadus suletud termodünaamilise süsteemi siseenergia muutuse, see on sama süsteemile tarnitud soojusenergia koguhulga ja süsteemis tehtud töö koguarvu võrra süsteemi. Seadust saab või saab jagada mitmeks protsessiks, sealhulgas isotermilise, isohoorse, isobaarse ja ka adiabaatilise protsessiks.
Termodünaamika teine seadus
Termodünaamika teine seadus käsitleb entroopiat. Teise termodünaamikaseaduse jaoks pole heli, Kelvin-Plank ja ka Clausius on välja andnud ühe väite eksperimentaalse fakti kohta või selle kohta.
- Clausius ütleb, et ühelgi süsteemil on võimatu töötada nii, et siis oleks ainus tulemus: on energia ülekandmine soojusena teatud temperatuuriga süsteemist kõrgema temperatuuriga süsteemi kõrge.
- Kelvin-Plancki väide on see, et süsteemil on võimatu seejärel tsüklis töötada termodünaamika ja annab ka selle ümber mõningast võrgutööd, saades samal ajal soojusenergia 1 termoreservuaar. (jaotises Insenertehnilise termodünaamika alused (Moran J., Shapiro N.M.– 6. väljaanne) - 2007 – Wiley) 5. peatükk.
Isoleeritud termodünaamilise süsteemi kogu entroopia kipub aja jooksul suurenema, seejärel läheneb maksimaalset väärtust nimetatakse seda ka entroopia suurendamise põhimõtteks "- see on korrelatsioon ülaltoodud II väitega (teise protsessi termodünaamika on entroopia omaduse kasutamine või kasutamine) (allikas Tehnilise termodünaamika alused (Moran J., Shapiro N.M. - 6. väljaanne - 2007 - Wiley)) 6. peatükk).
Kolmas termodünaamika seadus
Termodünaamika kolmas seadus käsitleb absoluutset nulltemperatuuri. See seadus ütleb siis, et kui süsteem saavutab siis nulli temperatuuri absoluutväärtus, siis kogu protsess peatub ja süsteemi entroopia läheneb väärtusele minimaalselt. Seadus ütleb ka, et täiusliku kristallstruktuuriga keha entroopia absoluutsel nulltemperatuuril on null.
Termodünaamika probleemide näited
Gaasi algmahuga 10 m3 kuumutatakse isobaarilistes tingimustes, kuni lõplik maht on 25 m3. Kui gaasi rõhk on 2 atm, määrake gaasi väline töö! (1 atm = 1,01 x 105 Pa).
Vastus:
Märkis, et:
V2 = 25 m3
V1 = 10 m3
P = 2 atm = 2,02 × 105 Pa
Küsimus on W?
Isobaarid → fikseeritud rõhk, kasutage valemit W = P (ΔV)
W = P (V2 V1)
P = 2,02x05 x (2510) = 3,03x106 džauli
Seega võib termodünaamika, põhimõtete, mõistete, valemite, seaduste ja näidete määratluse selgitus loodetavasti teile kasulik olla. aitäh
Vaata kaImperatiivsete, deklaratiivsete, küsivate lausete, omaduste ja näidete mõistmine
Vaata kaNormide, funktsioonide, omaduste, liikide ja näidete määratlus
Vaata kaHemoglobiini (Hb) määratlus, funktsioon, põhjus ja struktuur
