Benseeni määratlus, omadused, struktuur, tuletised ja klassifikatsioon
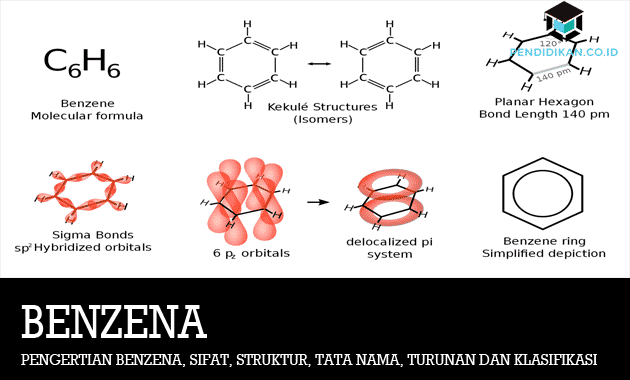
Benseeni määratlus
Benseen on naftatoode, mis on algselt valmistatud kivisöetõrvast ja mida kasutatakse igasuguste tarbekaupade ja tööstustoodete komponendina. Benseeni avastas Faradati mees, mille järel Mitscherlich määras hiljem molekulaarvalemi kui C6H6. Benseen kuulub ka süsivesinike ühendite klassi. Benseenil on kõrge küllastumisaste.
Seejärel klassifitseeritakse benseeniühendid ja ka mitmed nende derivaadid aromaatseteks ühenditeks, mis mille klassifikatsioon põhineb aroomil, mis mõnel neist ühenditest on. Kuid keemikud ei klassifitseeri neid keemilisi ühendeid enam põhineb ainult selle füüsikalistel omadustel, kuid põhineb struktuuril ja selle reaktsioonivõime.
Benseeni omadused
Üldiselt võib nende ühendite omadusi rühmitada kaheks, nimelt füüsikalised omadused ja keemilised omadused.
1. Füüsikalised omadused
Benseen on värvitu, lenduv ja väga mürgine vedelik. Benseeni saab või saab kasutada lahustina, igasuguste süsinikuühendite süntesaatorina ja süsinikuühendite valmistamise alusmaterjalina. Benseen ei ole eriti kõrge reaktsioonivõimega, kuid väga süsinikusisalduse tõttu väga tuleohtlik.
On mitmeid benseeni derivaate, millel on polaarsed ja mittepolaarsed omadused. See polaarne ühend on ühend, mis on moodustatud elektronide vahelise sideme olemasolu tõttu igas elemendis. Benseeni ja selle derivaatide keemistemperatuur algab 80–250 kraadi Celsiuse järgi. Sulamistemperatuur varieerub ka, kusjuures suurim arv on bensoehappe (-COOH) ühendis 122 kraadi Celsiuse järgi.
Keemistemperatuuri kõikumine on põhjustatud funktsionaalsete rühmade polaarsuse mõjust. Samuti mõjutab asendustemperatuur sulamistemperatuuri. Nagu benseen, on tolueenil ja etüülbenseenil mittepolaarsed omadused. Kui aniliinil, bensüülalkoholil, fenoolil ja bensoehappel on polaarsed omadused. Seega võib järeldada, et bensoehappel on selle polaarsema olemuse tõttu kõrgeim keemistemperatuur, samas kui benseeni keemistemperatuur on madalaim.
Mittepolaarsete omadustega benseeni derivaadid vees ei lahustu, vastupidi, need, millel on polaarsed omadused, lahustuvad vees.
Füüsikaliste omaduste omadused
- Lenduv vedelik
- Värvitu
- Lõhnab eriliselt
- Sulamistemperatuur 5,53 ° C
- Keemistemperatuur 80,1 ° C
- Mittepolaarsed ühendid
2. Keemilised omadused
See happesuse aste on benseeni ja selle derivaatide üks keemilisi omadusi. Fenool ja bensoehape on nõrgad happed. Bensoehape on fenoolist tugevam. Fenoolid, millel on -OH funktsionaalne rühm, on tegelikult nõrgad happed, mis tähendab, et nad annavad H + ioone, -NH2 rühma omava aniliini puhul on see nõrk alus, mis tähendab, et see aktsepteerib ioone H +. Benseenil on lihtsam läbi viia asendusreaktsioone kui liitumisreaktsioonidel.
Keemilised omadused
- Kogetakse liitmis- või asendusreaktsiooni, milles vesinikuaatomi asendamine benseenis on tuntud benseeni derivaadi ühendina.
- Sellel on vähem reaktiivseid omadusi, kuna resonantsi kogev konjugeeritud side võib või võib põhjustada benseenis oleva sideme väga stabiilsuse. Seetõttu nõuab reaktsioon benseenile reaktsiooni kiirendamiseks tavaliselt katalüsaatorit.
- On kasinogeensete (mürgiste) omadustega.
- Mittepolaarsed ühendid.
- Vähem reageeriv, kuid ka tuleohtlik ja tekitab ka palju tahma.
- Asendusreaktsioonide jaoks on seda lihtsam kui lisamist.
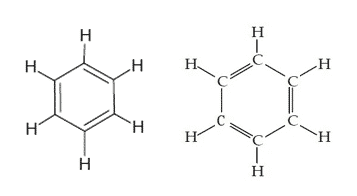
Benseeni struktuurivalem
Benseeni struktuur on kirjutatud kuueliikmelise (kuusnurkse) rõngana, mis sisaldab vahelduvaid ühe- ja kaksiksidemeid.
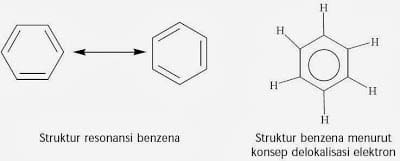
Koogistruktuur illustreerib seda, et mis tahes broomiaatomite asendamine vesinikul annab sama ühendi, kuna kõik kuus süsinikuaatomit ja vesinik on samaväärsed. Kekule võiks või võiks selgitada asjaolu, et kui benseen siis reageerib broomiga, kasutades FeCl3 katalüsaatorit, on molekulivalemiga ainult 1 ühend C6H5Br.
Seejärel on benseenitsükkel tavalise ringikujulise kuusnurga kujul selles sisalduv tingimus, et kuusnurga igas nurgas seoti seejärel a H aatomid.
Benseeni nomenklatuur
Allpool on benseeni nomenklatuur ja selgitus järgmine:
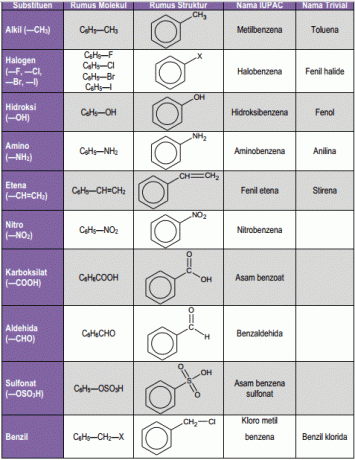
1. Benseen ühes asenduses

Ühe alküülasendajaga benseeni nimetatakse benseeni derivaadiks, näiteks etüülbenseeniks. IUPAC-süsteem kasutab jätkuvalt mõne monoasendatud benseeni, näiteks tolueeni, kumeeni, stüreeni üldnimetusi.
Neid üldnimetusi nagu fenool, aniliin, bensaldehüüd, bensoehape, anisool kasutatakse endiselt ka IUPAC-süsteemis. IUPAC-süsteem (Rahvusvaheline puhta ja rakendusliku keemia liit) on asutus, mis on volitatud sõnastama ühendite nomenklatuuri.
2. Benseen asendatud
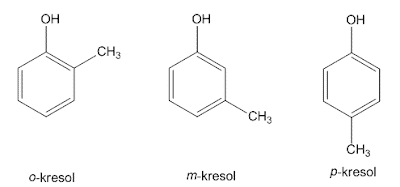
See asendaja on benseen, mis seob kahte asendajat, seega on võimalik omada kolme struktuurilist isomeeri. Kui need kaks asendajat on seotud 1,2-süsinikuaatomiga, nimetatakse seda üksteisega orto (o) 1, kui 1,3-süsinikku nimetatakse meta (m) ja 1,4 nimetatakse para (p).
See IUPAC-süsteem kasutab dimetüülbenseeni 3 isomeeri, nimelt o-ksüleeni, m-ksüleeni ja p-ksüleeni üldnimetust ksüleen. Kui 2 omo asendajat ei anna erilist nime, siis antakse igale asendajale a numbrid ja nimed sorteeritakse tähestiku järjekorras ning lõpevad seejärel sõnaga benseen. Süsinikuaatom, mille külge see asendaja on tähestikulises järjekorras kinnitatud, on nummerdatud 1.
3. Benseen polüasendus

Kui benseenitsükli külge on kinnitatud kolm või isegi rohkem asendajat, on nende asendajate asukoht tähistatud arvuga. Kui üks asendajatest annab erinime, siis antakse ühendi nimi, nimelt selle erinime tuletisena. Ja kui kõik asendajad ei anna erilist nime, siis on nende seisukoht siis väljendatud numbritega ja ka tähestikulises järjekorras, seejärel lõpeb sõnaga benseen.
Benseeni reaktsioon
Levinud reaktsioon on elektrofiilne asendusreaktsioon, mida on 4 tüüpi, sealhulgas:
1. Asendamine halogeeniga (halogeenimine)
See benseen asendatakse halogeeniga, kasutades raua (III) halogeniidkatalüsaatorit. Näited on:
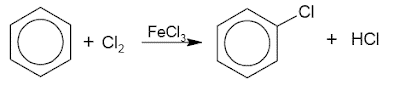
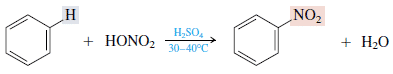
2. Asendamine lämmastikhappega (nitramine)
See benseen reageerib kontsentreeritud lämmastikhappega, kasutades kontsentreeritud väävelhappe katalüsaatorit, moodustades nitrobenseeni. Näiteks:
3. Asendamine kontsentreeritud väävelhappega (sulfoonimine)
See sulfoonimine toimub benseeni kuumutamisel kontsentreeritud väävelhappega. Näiteks:
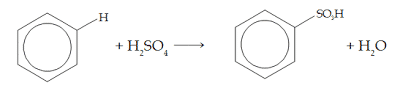
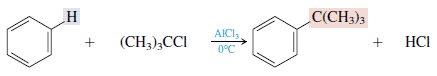
4. Asendamine alküülhalogeniididega (alküülimine)
Seda reaktsiooni saab kasutada alküülbenseeni moodustamiseks, kasutades alumiiniumkloriidi (AlCl3) katalüsaatorit. Näiteks:
Benseeni klassifikatsioon ja kasutusalad
Allpool on toodud mõned benseeni derivaadid ja nende kasutamine igapäevaelus.
-
Benseen
Benseeni kasutatakse laialdaselt lahustina, mis on põhiline materjal stüreenmonomeeri (C6H6 - CH = CH2) valmistamiseks. See stüreenmonomeer on polümeermaterjal sünteetilise kautšuki, pestitsiidide koostisosade, kunstlike magusainete valmistamisel. Peale selle kasutatakse benseeni ka nailonist alusmaterjalina. -
Bensoehape (C6H5COOH)
Bensoehapet või selle naatriumsoola kasutatakse säilitusainena igasuguste toiduainete või jookide valmistamiseks. See hape või sool valiti seetõttu, et see ei mõjuta konserveeritud toidu maitset. -
Fenool (C6H5OH)
Fenool võib või suudab hävitada mikroorganisme, nii et seda kasutatakse seejärel germitsiidina nagu põrandapuhastusvahendid (karboolhape). -
Salitsüülhape
See hape on tuntud kui o-hüdroksübensoehape. Selleks kasutatakse seda laialdaselt naha antiseptikuna, näiteks nahapulbrina. Samuti on peavalu leevendaja nagu aspiriin.
Benseeni derivaadid
-
Stüreen
Stüreen, tuntud ka kui vinüülbenseen või fenüületüleen, on benseeni vedel derivaat täpselt nagu õli, millel puudub värv ja mis aurustub kergesti, lõhnab see hästi, kuigi kontsentratsioonis on see veidi mädanenud kõrge. -
fenool
Fenool on happeliste omadustega ühend, mida tavaliselt kasutatakse antiseptikuna ja mida sageli nimetatakse ka karboolhappeks -
Alküülbenseen
Alküülbenseen oksüdeerudes võib toota bensoehapet. See reaktsioon ei sõltu süsinikuaatomite arvust -
Nitrobenseen
Nitrobenseen on plahvatusohtlik ühend, seetõttu kasutatakse seda nitrobenseeni ühendit sageli lõhkeainena -
Tolueen
Tolueen on värvitu vedelik, mis ei lahustu vees ja lõhnab nagu värvi vedeldaja -
Aniliin
Aniliin on benseeniühend, mis seondub amiinrühmaga -
Bensoehape
Bensoehape on lihtsaim aromaatne karboksüülhape. Bensoehape on valge värvusega tahke aine. Bensoehapet kasutatakse sageli teiste kemikaalide sünteesis
Benseeni ja selle järeltulijate kasutamine
Benseeni kasutatakse tavaliselt toorainena muude keemiliste ühendite, näiteks etüülbenseeni, tsükloheksaani ja kumeeni tootmiseks. Seda benseeni derivaati kasutatakse tavaliselt ka teiste ühendite valmistamiseks.
Seega võib benseeni määratluse, omaduste, struktuuri, nomenklatuuri, derivaatide ja klassifikatsiooni selgitus, loodetavasti, kirjeldatu teile kasulik olla. aitäh
Vaata kaKloroplastide, funktsioonide, struktuuride ja nende toimimise mõistmine
Vaata kaMaksud: määratlus, funktsioonid, eelised ja tüübid ekspertide sõnul
Vaata kaBUM-ide, omaduste, funktsioonide, tüüpide, eesmärkide ja näidete mõistmine
