Ioonvõlakirjade määratlus, terminid, omadused, omadused, moodustumine, näited
Joonise võlakirja määratlus
See iooniline side on side, mis tekib positiivsete ja negatiivsete ioonide vahelise atraktiivse jõu tagajärjel. Need positiivsed ioonid moodustuvad seetõttu, et metallilised elemendid kaotavad elektrone, negatiivsed aga seetõttu, et mittemetallilised elemendid saavad elektrone. See iooniline side tekib elektronide ülekande tõttu.
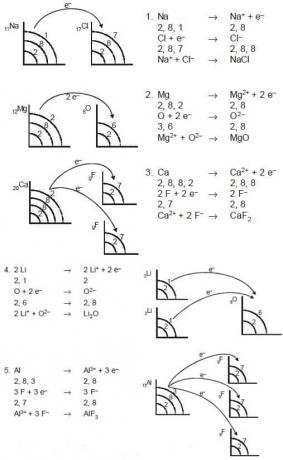
See iooniline side tekib elektronide kaotamise või ka aatomite sidumise kaudu vastuvõtmise tulemusena. Elektrone kaotavad aatomid muutuvad positiivseteks ioonideks (katioonideks), samas kui elektrone vastuvõtvad aatomid muutuvad negatiivseteks (anioonideks). Neid ioonisidemeid nimetatakse tavaliselt elektrovalentseteks sidemeteks. Ühendeid, millel on ioonsidemed, nimetatakse ioonühenditeks. Need ioonsed ühendid moodustuvad tavaliselt metalliliste ja mittemetalsete elementide aatomite vahel. Metalliliste elementide aatomid kipuvad kaotama elektrone positiivsete ioonide moodustamiseks ja mittemetallide aatomid kipuvad elektrone omandama ja moodustama negatiivseid ioone. Näited on näiteks: MgO, CaF2, NaCl, Li2O, AlF3 ja teised.
Aatomi sidemete moodustumise tingimused
Seejärel moodustavad aatomid ioonisidemeid, kuna igaüks neist aatomitest soovib saavutada tasakaalu / stabiilsuse, mis on nagu väärisgaaside elektronstruktuur. Ioonisidemed tekivad järgmiste vahel:
- negatiivsete ioonidega positiivsed ioonid,
- Nendel aatomitel on väikesed ionisatsioonipotentsiaalenergiad suure elektron afiinsusega aatomitega (IA rühma aatomid, IIA elementide aatomid VIA rühma aatomitega, VIIA elementide aatomid),
- Väikese elektronegatiivsusega aatomid on suure elektronegatiivsusega aatomid.
Iooniline side on side, mis tekib tänu elektronide ülekandele ühest aatomist teise (James E. Brady, 1990). Iooniline side on elektronide (metall) loovutava aatomi ja elektrone omandava aatomi (mittemetall) vahel. Metalli aatom muutub pärast elektronide vabastamist positiivseks iooniks.
Kuigi see aatom pole metall, muutub see pärast elektronide vastuvõtmist negatiivseks iooniks. Ioonide vahel, mille laengud on vastupidised, on atraktsioon (elektrostaatiline jõud), mida nimetatakse iooniksideks (elektrovalentseks sidemeks). Ühendeid, millel on ioonsidemed, nimetatakse ioonühenditeks. Need ioonsed ühendid moodustuvad tavaliselt metalliliste ja mittemetalsete elementide aatomite vahel.
Joonise võlakirjade moodustumine
Iooniliste sidemete moodustamise protsessi ilmestab NaCl moodustumine. Naatrium (Na) on elektronkonfiguratsiooniga (2,8,1) on stabiilsem, kui see vabastab 1 elektroni nii, et siis muutub elektronide konfiguratsioon väärtuseks (2,8). Mis puutub kloori (Cl), millel on ja / või on konfiguratsioon (2,8,7), on see stabiilsem, kui see saab 1 elektroni, nii et konfiguratsioon muutub seejärel (2,8,8). Nii et need kaks muutuvad siis stabiilsemaks, siis annetab naatrium 1 elektroni ja kloor saab siis naatriumist elektroni.
Kui naatrium kaotab ühe elektroni, muutub see naatrium väiksemaks. Kuigi kloor muutub ühe elektroni lisamise tõttu suuremaks. Seetõttu on positiivse iooni suurus alati väiksem kui eelmine, kuid negatiivse iooni puhul kipub see olema suurem kui eelmine suurus. Kui toimub elektronivahetus, saab Na positiivselt laetud (Na +) ja Cl negatiivselt laetud (Cl-). Pärast seda on Na + ja Cl vahel elektrostaatiline jõud, moodustades ioonisidemeid.
Nagu eespool mainitud, on ioonne side sideme, mis tekib elektronide ülekandumise tõttu ühest aatomist teise. Tuleb meeles pidada, et nende elementide vahelised sidemed on stabiilsed, kui kõige kaugemad elektronid on 2 ja 8. siis vaadake allpool olevate elementide Na (naatrium) ja ka Cl (kloriid) ioonsete sidemete moodustumise näidet:

Ioonsed sidemed on suhteliselt tugevad sidemed. Toatemperatuuril on kõik need ioonsed ühendid kristallilised tahked ained ja teatud struktuuriga. Lewise sümboli abil kirjeldatakse NaCl moodustumist järgmiselt.

Lewise elektronpunktisümbol koosneb nii elemendi sümbolist kui ka punktidest igas punktis, mis tähistavad elemendi aatomi ühte valentselektroni. Elektroni punktid on äärmised elektronid.

Ioonilised liimimisomadused

Lisaks suhteliselt tugevale olemusele on sellel ioonsidemel ka mitmeid muid omadusi, sealhulgas järgmised:
- Sellel on kõrge keemis- ja sulamistemperatuur. Nende mitte-vabade ioonsete ühendite kristallides liikuvad positiivsed ja ka negatiivsed ioonid, kuna neid seovad tugevad elektrostaatilised jõud. Kõrged temperatuurid on vajalikud, et ioonid saaksid elektrostaatiliste jõudude ületamiseks piisava kineetilise energia.
- Raske, kuid habras. Sellel on rasked omadused, kuna positiivsed ja negatiivsed ioonid on elektrostaatiliste jõudude poolt tugevalt seotud igas suunas. Hapruse olemus on tingitud asjaolust, et kihid võivad või võivad väliste jõudude mõjul nihkuda, sellised ioonid võivad või see võib olla üksteise peal, nii et siis tekib väga tugev tõrjumine, mis põhjustab selle juhtumise eraldamine.
- Toatemperatuuril on see tahke aine.
- Lahustub vees lahustites, kuid praktiliselt ei lahustu orgaanilistes lahustites
- See ei juhi elektrit tahkes faasis, vaid elektrit vedelas faasis. Öeldakse, et aine suudab juhtida elektrit, kui on ioone, mis võivad või võivad elektrilaengut kandes vabalt liikuda.
Ioonse võlakirja omadused
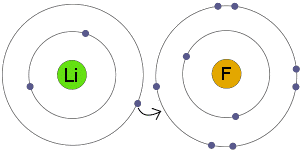
Ioonsidemete olemasolu mõjutab ka saadud ühendi keemilisi ja füüsikalisi omadusi. Seal on mõned neist ioonsidemete silmapaistvatest omadustest ja allpool on loetletud mõned järgmised ioonsidemete omadused:
Tulenevalt asjaolust, et need metallid kipuvad kaotama elektrone ja mittemetallid kipuvad elektrone, on metallide ja mittemetallide vahel tavalised ioonsidemed. Seetõttu, erinevalt kovalentsetest sidemetest, mis võivad tekkida või võivad tekkida ainult mittemetallide vahel, võivad sellised ioonsidemed tekkida või võivad tekkida ka metallide ja mittemetallide vahel.
Ioonühendite nimetamisel on selle metalli nimi alati esikohal ja mittemetalli nimi teisel kohal. Näiteks naatriumkloriidi (NaCl) korral on naatrium metall, kloor aga mittemetall.
Ioonseid sidemeid sisaldavad ühendid on vees ja ka mõnes muus polaarses lahustis kergesti lahustuvad. Iooniline sidumine mõjutab seega saadud ühendi lahustuvust.
Kui need ioonsed ühendid lahustatakse lahustis homogeense lahuse saamiseks, kipub lahus juhtima elektrit.
Need ioonsed sidemed mõjutavad ka ühendi sulamistemperatuuri, kuna neil ioonsetel ühenditel on kalduvus kõrgem sulamistemperatuur, mis tähendab, et iooniline side püsib stabiilsena laiemas temperatuurivahemikus suur.
Iooniline sidumine tekib positiivse laenguga ioonide ja negatiivselt laetud ioonide vahelise külgetõmbe tõttu.
Nagu väitis Wibowo (2013), tuleb kaaluda mitut asja, tavaliselt on selles keemilises sidematerjalis kontseptuaalne viga, näiteks järgmine näide:
- See iooniline side võib tekkida või võib tekkida ainult lihtsate katioonide ja anioonide vahel,
- Neid ioonseid ühendeid saab või saab moodustada ainult otse ioonidest jne.
Valemis või ka ioonvalemis. Neid ioonseid ühendeid molekulidena ei eksisteeri, seega ei saa me ioonsete ühendite molekulaarsetest valemitest teada ega saa neid teada. Selle asemel on ühendi ioonvalem selle ühendi empiiriline valem. Näiteks on naatriumkloriidi valem NaCl.
Saunders (2007) väitis, et ioonvõres on mitu võrdset kogust ioone, näiteks:
- Magneesiumoksiid sisaldab Mg2 + ja O2- ioone ning valem on MgO
- Kaltsiumkloriid sisaldab Ca2 + ja Cl2-ioone ning valemiks on CaCl2
- See alumiiniumoksiid sisaldab Al3 + ja O2-ioone ning valem on Al2O3
Näide NaCl ioonse sideme moodustumisest
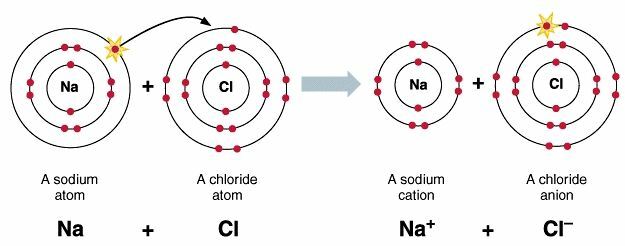
Kui Na-aatom läheneb Cl-le, siis Na neelab teatud ionisatsioonienergia, nii et see on seejärel võimeline vabastama elektroni ja muutuma Na⁺-ioonideks.
Na = 2. 8. 1> neelab seejärel energiat ja moodustab Na⁺ioone
Cl = 2. 8. Seejärel vabastab energia ja moodustab Cl⁻ ioone.
Naatomi vabanenud elektronid võetakse seejärel vastu Cl-aatomi poolt, nii et Cl-aatom muutub Cl atom-iooniks. See elektronide sidumisprotsess vabastab seejärel teatud energia, mis on võrdne selle elektronide afiinsusega.
Na2- ja Cl2-ioonide vahel on elektrostaatiline külgetõmbejõud, nii et seejärel moodustuvad NaCl ioonsed ühendid.
Seega võib ioonvõlakirjade määratluse, terminite, omaduste, omaduste, moodustumise ja näidete selgitus loodetavasti teile kasulik olla. aitäh
Vaata kaMunasarjade, nende struktuuri ja osade ning nende funktsioonide mõistmine
Vaata kaSirge liikumise määratlus
Vaata kaElektroskoopi mõistmine
