Elektroonide afiinsuse, omaduste, tüüpide ja mustrite mõistmine
Haridus. Co ID - Elektronide afiinsus on neutraalsete aatomite kujul vabanenud või neeldunud energia mõõt gaas, kui selle väliskesta asetatakse üks elektron ja ka aatom muutub iooniks negatiivne. Elektroni afiinsus võib olla positiivne või negatiivne. Elektroni afiinsus on negatiivne, kui elektroni püüdmise käigus vabaneb energia. Selle protsessi tulemusena moodustunud negatiivsed ioonid on stabiilsed. Kui elektroni püüdmise protsessis neeldub energia, juhtub vastupidi. Selle energia neelamine põhjustab moodustunud ioonide ebastabiilsust. Nii et mida negatiivsem on elektroni afiinsuse väärtus elemendi aatomi suhtes, seda stabiilsem moodustub ioon. lisateabe saamiseks allpool:
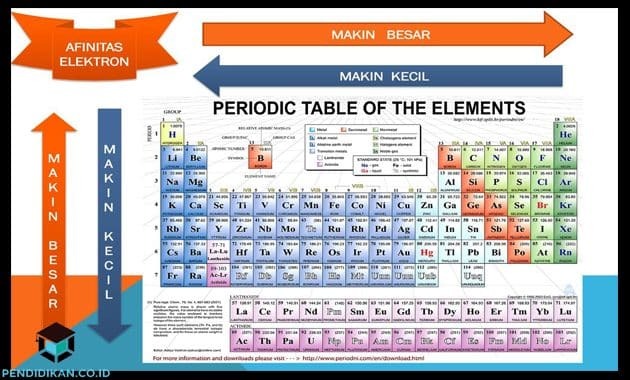
Elektroni afiinsuse mõistmine
Elektroni afiinsus on defineeritud kui neutraalse aatomi energia muutus (kJ / mol) (gaasifaasis), kui elektron lisatakse aatomile negatiivse iooni moodustamiseks. Teisisõnu, neutraalse aatomi tõenäosus saada või saada elektrone. Elektroni afiinsus on üks elementide perioodilistest omadustest. Kuna energia vabaneb, antakse elektroni afiinsusväärtusele miinusmärk.
Elektronide afiinsusomadused elementide perioodilises süsteemis
- Rühma piires kipub see elektronide afiinsus ülevalt alla vähenema
- Perioodil kipub see elektronide afiinsus suurenema vasakult paremale.
- Välja arvatud leelismuldmetallid ja väärisgaasid, on kõigil põhirühma elementidel negatiivne elektronide afiinsus. Halogeenidel on suurim elektronide afiinsus.
Kui neutraalsele aatomile lisatakse elektron, see tähendab esimese elektroni afiinsus, vabaneb energia; seega on esimese elektroni afiinsus negatiivne. Kui aga negatiivsele ioonile lisatakse elektron, st mõlemad elektronide afiinsused, on vaja rohkem energiat. Seega vabaneb rohkem energiat, et oleks võimalik ioonile elektrone lisada, kuna negatiivne ioon peab sundima elektroni sisenema elektronorbiiti; seega on teise elektroni afiinsus positiivne.
Esimese elektroni afiinsus:
- X (g) + e- → X- (g) (1)
Teise elektroni afiinsus:
- X- (g) + e- → X2- (g) (2)
Ionisatsioonienergia on alati seotud positiivsete ioonide moodustumisega. Elektroni afiinsus on negatiivse iooni oma ja selle kasutamine piirdub peaaegu alati perioodilisustabeli rühmade 16 ja 17 elementidega. Esiteks on elektronide afiinsus energia, mis vabaneb, kui 1 mol gaasilisi aatomeid kogub elektrone, moodustades 1 mooli gaasilisi ioone -1. See on selle muutuse korral vabanev energia (ühe mooli kohta X). Esimese elektroni afiinsusel on negatiivne väärtus. Näiteks on kloori esimese elektroni afiinsus -349 kJ / mol. Kokkuleppeliselt näitab negatiivne märk energia vabanemist.
Elektroni afiinsuse tüüp
See elektronide afiinsus jaguneb metalli ja mittemetallide elektronide afiinsuseks, selgitus on järgmine:
Metalli elektronide afiinsus
Kui metallielemendile lisatakse elektron, on selle elektroni saamiseks vaja energiat (endotermiline reaktsioon). Metallil on vähem võimalusi elektronide saamiseks, kuna on lihtsam kaotada elektronvõrk ja moodustada ka katioon. Valentselektrone on lihtsam kaotada, kuna metallide tuumad ei ole nende valentselektronide suhtes tugeva ligitõmbega. Seega on metallil teadaolevalt madalam elektronide afiinsus. Madalama elektronide afiinsuse kalduvust metalli suhtes kirjeldatakse järgmiselt.
Liitium (Li): 60 KJ / mol
Naatrium (Na): 53 KJ / mol
Kaalium (K): 48 KJ / mol
Rubiidium (Rb): 47 KJ / mol
Tseesium (Cs): 46 KJ / mol
Pange tähele, et elektronide afiinsus väheneb ühes (1) rühmas
Mittemetallide elektronide afiinsus
Kui mittemetall saab elektrone, on energia muutus tavaliselt negatiivne, kuna nad kulutavad energiat anioonide moodustamiseks (eksotermiline protsess); seetõttu on elektronide afiinsus negatiivne arv.
Nendel mittemetallidel on nende aatomstruktuuri tõttu suurem elektronide afiinsus kui metallidel:
- Esiteks on mittemetallidel rohkem valentselektrone kui metallidel, seega on mittemetallidel lihtsam saada elektrone, et täita stabiilseid oktette ja
- teiseks, elektroni valentskest on tuumale lähemal, seega on elektroni eemaldamine raskem ja elektronide ligimeelitamine teistest elementidest (eriti metallidest).
Seega on neil mittemetallidel kõrgem elektronide afiinsus kui metallidel, mis tähendab, et nad saavad suurema tõenäosusega elektrone madalama elektron afiinsusega aatomitest.
Näiteks mittemetallidel, näiteks rühma 17 halogeenirea elementidel, on suurem elektronide afiinsus kui metallidel. Seda suundumust selgitatakse järgmiselt. Vaadake negatiivset märki (-) elektronide afiinsuse kohta, mis näitab või viitab energia vabanemisele.
Fluor (F): -328 kJ / mol
Kloor (Cl): -349 kJ / mol
Broom (Br): -324 kJ / mol
Jood (I): -295 kJ / mol
Pange tähele, et elektronide afiinsus väheneb, kui rühm läheb, kuid suureneb aja jooksul.
Elektroni afiinsusmuster
See elektronide afiinsus suureneb rühma jaoks ja ka perioodilisustabeli perioodil vasakult paremale elektronid lisatakse energiatasemele, et olla tuumale lähemal, nii et tuuma ja elektron. Pidage meeles, et mida suurem on vahemaa, seda vähem on atraktsioon; seega vabaneb vähem energiat, kui elektron lisatakse orbiidilt. Peale selle, mida rohkem on elemendil valentselektrone, seda tõenäolisem on elektronide saamiseks stabiilne oktett. Mida vähem on aatomil valentselektrone, seda tõenäolisemalt saab see elektrone.
Elektronide afiinsus väheneb perioodilisustabeli perioodide lõikes rühmas ja paremalt vasakule kuna elektronid asetatakse tuumast kaugemale kõrgematele energiatasemetele, nii väheneb ka tõmba seda. Võib siiski arvata, et valentselektronide arvu suurenemisel ja vähenemisel peab element olema stabiilsem ja suurema elektronide afiinsusega. Üks ei suuda kilbi mõju selgitada. Ühe perioodi vähenemisel suureneb varjestusefekt, nii et elektronide vahel tekib tõrjumine. Sellepärast väheneb atraktsioon elektroni ja tuuma vahel perioodilisustabeli ühe laskuva rühmana.
See on kõik ja aitäh, et lugesite elektronide afiinsuse määratluse, omaduste, tüüpide ja mustrite kohta, loodetavasti võib see teile kasulik olla.
Vaata kaRinnaku mõistmine
Vaata kaSüljenäärmete (süljenäärmed) määratlus
Vaata kaTsentrioolide määratlus
