CALOR: fórmulas, tipos, problemas de muestra (resumen)
Cargando...
La fórmula del calor es algo familiar para encontrar en las lecciones de física. El calor es una forma de energía que un objeto puede recibir o liberar. El calor tiene unidades llamadas julios o calorías.
El calor se puede interpretar como la energía térmica que poseen ciertas sustancias y se puede detectar midiendo la temperatura del objeto. Puedes ver la aplicación de calor al agua tibia que se deja abierta, enfriándose gradualmente (ya no se calienta más) porque el calor se libera del agua al aire.
Lista de contenidos
Definición de Caloría

El calor es una energía que puede pasar de un objeto con una temperatura más alta a un objeto con una temperatura más baja cuando los dos objetos se tocan o se juntan. Dos objetos con diferentes temperaturas harán que el calor fluya y se mueva.
Por ejemplo, cuando mezclas agua caliente y agua fría, el agua que se combina se convierte en agua tibia. También tienes que entender que la temperatura y el calor son dos cosas diferentes. La temperatura es un valor que se puede medir con un termómetro, mientras que el calor es energía que fluye.
Según el Sistema Internacional (SI) o MKS, la unidad de calor es Joule (J), mientras que según CGS la unidad de calor es ergio. Para varios tipos de alimentos, el calor utiliza la unidad de calorías.
Una caloría se define como la cantidad de energía calorífica necesaria para elevar la temperatura de 1 gramo de agua a 1 grado Celsius. Por lo tanto, se puede concluir que 1 caloría = 4,184 julios o, en general, se redondea directamente a 4,2 J.
Fórmula de calorías
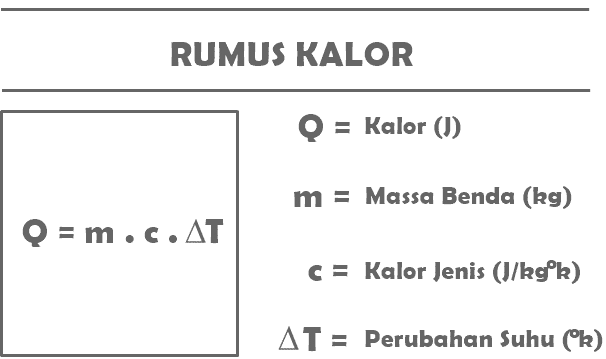
De acuerdo con la definición de calor que has leído anteriormente, las siguientes son algunas de las fórmulas que se han resumido en relación con el calor material en las asignaturas de Física.
1. Fórmula de transferencia de calor
Q = m. C. T
Con:
Q = la cantidad de calor recibido o liberado por un determinado objeto (J)
m = masa del objeto que recibe o libera calor (kg)
c = calor específico de la sustancia (J/kg°C)
T = cambio de temperatura (°C)
2. Fórmula de calor específico
El punto de referencia de esta fórmula es la fórmula de transferencia de calor, eliminando el elemento c (calor específico de la sustancia) para calcularlo matemáticamente como de costumbre.
c = Q / (m. T)
Con:
c = calor específico de la sustancia (J/kg°C)
Q = la cantidad de calor recibido o liberado por un determinado objeto (J)
m = masa del objeto que recibe o libera calor (kg)
T = cambio de temperatura (°C)
3. Fórmula de capacidad calorífica
C = Q / T
Con:
C = capacidad calorífica (J/°K)
Q = mucho calor (J)
T = cambio de temperatura (Kelvin/K)
4. Fórmula para determinar la capacidad calorífica
C = m. C
Con:
C = capacidad calorífica (J/°K)
m = masa del objeto que recibe o libera calor (kg)
c = calor específico de la sustancia (J/kg°K)
5. Calor de fusión y fórmula de vapor
La fórmula para el calor de fusión es la siguiente.
Q = m. L
La fórmula para el calor del vapor es la siguiente.
Q = m. tu
Con:
Q = mucho calor (J)
m = masa del objeto (kg)
L = calor de fusión (J/kg)
U = calor de vapor de la sustancia (J/kg)
Leer: Termodinámica
Tipos de calorías

Hay varios tipos de calor que se distinguen según el proceso de trabajo en una sustancia en particular. A continuación se muestran los tipos de calor que debe comprender para poder ver su aplicación en la vida cotidiana.
1. Calor de formación (ΔHf)
El calor de formación es el calor producido o requerido para formar 1 mol de un compuesto en sus elementos, como los gases, que se escriben usando la fórmula molecular. Algunos ejemplos de calor de formación son C12, oh2, hermano2, h2.
2. Calor de descomposición (ΔHd)
El calor de descomposición es la forma de calor producido o requerido para descomponer 1 mol de un compuesto en otro elemento.
3. Calor de Combustión (ΔHc)
El calor de combustión es el calor ganado o necesario para quemar 1 mol de una sustancia, como un elemento o su compuesto.
4. Calor de Neutralización (ΔHn)
El calor de neutralización es el tipo de calor obtenido o requerido para formar un mol de H2O de la reacción entre un ácido y una base. Este calor es una reacción exotérmica porque hay un aumento de temperatura.
5. Calor de disolución (ΔHs)
El calor de disolución es el tipo de calor producido o requerido para disolver 1 mol de una sustancia que originalmente era sólida en una solución.
Leer: Fórmula de densidad
Calor específico y capacidad calorífica
También necesita saber que el calor puede fluir en dos sustancias que tienen diferentes partículas de materia y diferentes cambios de temperatura. Por ejemplo, cuando el agua y el aceite se calientan a la misma temperatura, la temperatura del aceite cambia más que la temperatura del agua.
Esto puede suceder porque hay diferentes tipos de calor en dos objetos que se juntan o juntan. El calor específico es la cantidad de calor necesaria para elevar la temperatura de 1 kg de masa a 1°C, la unidad es calorías/gramo°Celcius o J/kg°C.
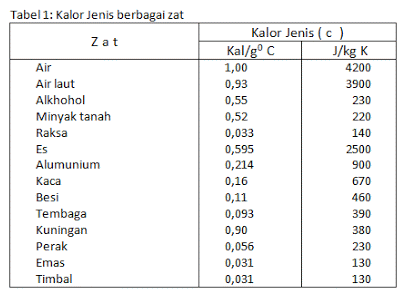
Cada sustancia tiene su propio calor específico y hay diferencias en él. Por su parte, la noción de capacidad calorífica es la cantidad de calor necesaria o absorbida para poder elevar la temperatura de un objeto a 1°C.
Cambio de calor
En su aplicación, la fórmula del calor funciona según el principio que cambia dos sustancias que se juntan o están en contacto entre sí. A continuación se muestra un cambio de calor que ocurre cuando hay sustancias que se juntan o juntan.
1. El calor puede cambiar la temperatura de una sustancia
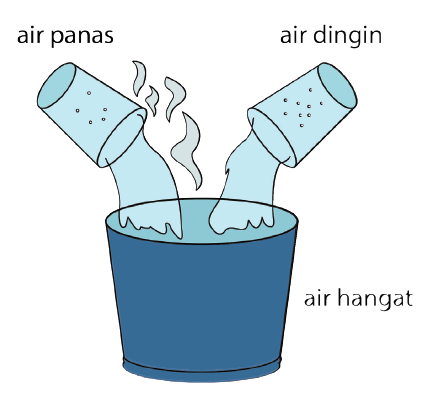
Cada objeto básico tiene una temperatura inferior al cero absoluto, por lo que el objeto debe tener calor. Este contenido determinará más tarde cuánto calor tiene la temperatura del objeto.
Cuando el objeto se calienta, obtendrá calor adicional. La temperatura también aumentará o aumentará. Por el contrario, si el objeto se enfría, se liberará calor y provocará una disminución de la temperatura.
2. El calor puede cambiar las sustancias

En algunos tipos de objetos, cuando se les da calor en ciertas unidades, el objeto puede sufrir un cambio de estado. Por ejemplo, si al hielo se le da calor (se calienta), el hielo cambiará de sólido a líquido o incluso a gas.
Si el proceso de calentamiento se lleva a cabo de forma continua, eso es lo que hace que el agua cambie de forma nuevamente a una sustancia. Esto sucede cuando el objeto que está a punto de cambiar de forma se mueve desde el punto del líquido hasta el punto de fusión del objeto.
Tipos de transferencia de calor
Después de pasar por una explicación de la definición, los tipos, las fórmulas del calor y los cambios en el calor, puedes concluir que el calor también puede moverse cuando se encuentra o entra en contacto con otros objetos. Los siguientes son algunos tipos de transferencia de calor.
1. Conducción

La transferencia de calor por conducción ocurre cuando pasa a través de una sustancia intermedia como un metal, pero no va seguida de un movimiento permanente de partículas en la sustancia. Por ejemplo, cuando calienta un extremo de un metal, el otro extremo del metal también se calienta.
Esto se debe a la conducción del calor de una temperatura alta a una temperatura más baja. La punta de metal calentada hará que las partículas de metal creen vibraciones en otras partículas conectadas a ellas.
Por lo tanto, todas las partículas de metal vibran incluso si solo se calienta un extremo del metal, lo que provoca la transferencia de calor. Otro ejemplo es cuando el escape de la motocicleta está caliente cuando el motor está encendido.
La conducción también ocurre cuando sostienes fuegos artificiales, sostienes la tapa de una olla que se siente caliente durante el proceso de cocción, mantequilla que se derrite cuando se calienta, etc. La fórmula para la transferencia de calor por conducción es la siguiente.
Tasa de calor = Q/t = kA. t / x
2. Convección
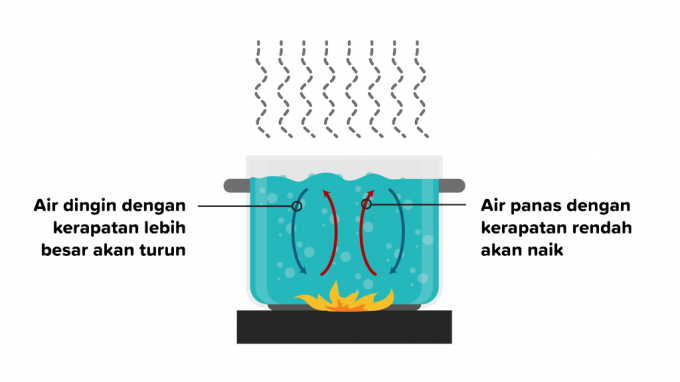
La convección es la transferencia de calor en la que el calor pasa a través de una sustancia y es seguido por el movimiento de partes de la sustancia. La transferencia de calor por convección puede ocurrir en líquidos o gases, por lo que la convección se divide en dos de la siguiente manera.
una. Convección científica
La convección es una transferencia de calor que ocurre debido a la flotabilidad sin factores externos y está influenciada por diferentes tipos de objetos. Un caso de ejemplo es cuando se calienta agua, la densidad de las partículas de agua caliente se alejará del fuego, luego una sustancia de agua a temperatura más baja la reemplazará.
b. Convección forzada
Anuncio publicitario
La convección es una transferencia de calor provocada por la influencia de factores externos, como la presión, de modo que la transferencia se produce de forma intencionada o forzada. Es decir, el calor se ve obligado a trasladarse a un lugar debido a la ayuda.
Ejemplos de casos son cuando un ventilador produce aire frío en un lugar que se siente caliente, el sistema de enfriamiento del motor en el radiador del automóvil, etc.
Otra aplicación de la convección ocurre cuando se calienta agua, donde hay un movimiento de agua hacia arriba y hacia abajo, las semillas de judías verdes que sube y baja al hervir, el proceso de la brisa de la tierra y del mar, el movimiento de los globos aerostáticos, el humo de las chimeneas fábrica.
La fórmula para la transferencia de calor por convección es la siguiente.
Tasa de calor = Q/t = hA. T
3. Radiación

La radiación es la transferencia de calor que no requiere una sustancia o medio intermedio. La transferencia de calor en la radiación no es lo mismo que la conducción y la convección. El desplazamiento en la radiación no siempre hace que las dos sustancias entren en contacto o se encuentren, porque el calor puede transferirse incluso sin un intermediario.
Es decir, el calor será irradiado en todas las direcciones por la propia fuente de calor, luego fluirá en todas las direcciones posibles. Básicamente, todos los objetos pueden emitir y absorber radiación de calor, pero la cantidad depende de la temperatura y el color de la sustancia.
Cuanto más caliente es un objeto que la temperatura que lo rodea, más calor irradia a su entorno. Entonces, si el área de la superficie de un objeto caliente es mayor, el calor que se irradiará será más caliente.
Un ejemplo de casos de radiación en la vida cotidiana es cuando haces una fogata, se sentirá caliente. Debido a que la fuente de fuego está a cierta distancia, la radiación se siente cuando las palmas de las manos se calientan cuando se acercan. con fuego. La fórmula de calor para la radiación es la siguiente.
Tasa de calor = Q/t = eσAT4
4. calor aislante

El calor tiene la propiedad de ser fácilmente transferido. Puede evitar que ocurra el movimiento, ya sea por conducción, convección y radiación. Por ejemplo, aislando la habitación; El termo puede mantener la temperatura del agua caliente o tibia, de modo que se pueda evitar la transferencia de calor.
Leer: sustancia gaseosa
Ejemplo de problema de calorías

¡La fórmula del calor es un método que puedes usar para trabajar en los siguientes ejemplos de preguntas!
1. Ejemplo de pregunta 1
Un objeto tiene una temperatura de 5°C y absorbe 1500 J de calor. La temperatura del objeto cambia a 32°C. ¡Calcula la capacidad calorífica del objeto!
Solución:
Q = 1500J
T = 32°C – 5°C = 27°C = 300°K
C = Q / T
C=1500/300
C = 5 J/°K
2. Pregunta de ejemplo 2
Calcule el calor requerido para calentar 5 kg de agua a 25°C a 105°C si se sabe que el calor específico del agua es 1000 J/kg°C.
Solución:
m = 5 kg
c = 1000 J/kg°C
T = 105°C – 25°C = 80°C
Q = m. C. T
Q = 5. 1000. 80
Q = 400 000 J
3. Ejemplo de pregunta 3
Si un agua tiene una masa de 3 kg y se calienta de 30°C a 100°C y su calor específico es de 1 J/g°C, ¡calcule la cantidad de calor requerida para el agua!
Solución:
m = 3 kg
c = 1 g/°C = 1000 J/kg°C
T = 100°C – 30°C = 70°C
Q = m. C. T
Q = 3. 1000. 70
Q = 210 000 J
4. Pregunta de ejemplo 4
Un líquido tiene una masa de 5 kg. El líquido requiere un calor de 200 000 J y se calienta de 20 °C a 80 °C. ¡Calcule el calor específico del líquido!
Solución:
m = 5 kg
Q = 200 000 J
T = 80°C – 20°C = 60°C
c = Q/m. T
c = 200.000 / 5. 60
c = 200.000 / 300
c = 666,67 J/kg°C
5. Pregunta de ejemplo 5
Un aluminio tiene una masa de 5 kg. La temperatura inicial es de 25°C. Si el aluminio recibe 250 000 J de calor y su calor específico es de 900 J/kg°C, ¡calcule la temperatura final del aluminio!
Solución:
m = 5 kg
Q = 250 000 J
c = 900 J/kg°C
T1 = 25°C
Q = m. C. T
250.000 = 5. 900. (T2 – 25)
T2 – 25 = 250.000 / 5. 900
T2 – 25 = 250.000 / 4.500
T2 – 25 = 55,56
T2 = 55,56 + 25 = 80,56°C
6. Pregunta de ejemplo 6
Son 300 gramos de agua a una temperatura de 25°C, serán calentados con una energía de 1.500 calorías. Si el calor específico del agua es 1 cal/g°C, ¡calcule la temperatura del agua después de calentarla!
Solución:
m = 300 gramos
T1 = 25°C
c = 1 cal/g°C
Q = 1500 calorías
Q = m. C. T
1.500 = 300. 1. (T2 – 25)
T2 – 25 = 1500 / 300. 1
T2 – 25 = 5
T2 = 5 + 25 = 30°C
7. Pregunta de ejemplo 7
Hay 300 gramos de agua para calentar de 40°C a 65°C. Si el calor específico del agua es 1 cal/g°C o 4200 J/kg°K, calcule:
- Se recibe mucho calor en calorías.
- ¿Cuánto calor se recibe en Joules?
Solución:
m = 300 g = 0,3 kg
T = 65 – 40 = 25°C
c = 1 cal/g°C = 4200 J/kg°K
- Calorías en calorías
Q = m. C. T
Q = 300. 1. 25
Q = 7500 calorías
- calor en julios
Q = m. C. T
Q = 0,3. 4.200. 25
Q = 31 500 calorías = 132 300 julios
Con base en la explicación anterior, la fórmula del calor no solo gira en torno a liberar y requerir calor, pero hay un cambio de calor, transferencia de calor, incluso el calor específico de cada sustancia que variar. ¡Feliz práctica y espero que este artículo sea útil!
X CERRAR
anuncios
ANUNCIO PUBLICITARIO
X CERRAR
