Ejemplo de un problema de molalidad: fracción molar, fórmula y solución
Ejemplo de problema de molalidad: fracción molar, fórmula y solución: En esta ocasión Sobre el conocimiento.co.id discutiremos la molalidad con varios ejemplos de preguntas y por supuesto sobre otras cosas que también la abarcan. Miremos la discusión juntos en el artículo a continuación para entenderlo mejor.
Ejemplo de un problema de molalidad: fracción molar, fórmula y solución
La molalidad o concentración molal es una medida de la concentración de un soluto en una solución en términos de la cantidad de sustancia en una cierta masa del solvente. Esto es diferente de la definición de molaridad que se basa en un cierto volumen de solución.
La unidad común de molalidad en química es mol/kg. Una solución con una concentración de 1 mol/kg también se expresa a veces como 1 molal. El término molalidad se forma en analogía con la molaridad, que es la concentración molar de una solución.
La molalidad de una solución se puede probar agregando un poco de solvente. Más simplemente, la molalidad (m) de una solución son los moles de soluto divididos por los kilogramos de solvente. La molalidad o molalidad es la concentración de una solución que indica el número de moles (n) de soluto en 1 kg o 1000 gramos de disolvente.
La diferencia entre molalidad y molaridad es que si molalidad es molalidad o concentración molal (m) expresa el número de moles soluto en 1000 gramos de solvente mientras que la molaridad es una declaración de la cantidad de moles de soluto en cada litro solución. La molaridad está representada por la notación M y las unidades son moles/litro.
Fórmula de molalidad
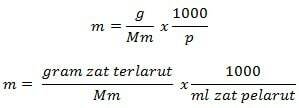
Información
m = molalidad (mol/kg)
g = gramos de soluto (g)
Mm = masa molar de la sustancia (g/mol)
P = masa de disolvente (g)
Relación de molalidad con porcentaje de masa
El porcentaje de masa es una unidad de concentración comúnmente utilizada en soluciones químicas. Ejemplos de soluciones que podemos encontrar todos los días son la solución de alcohol al 75% y la solución de ácido acético al 24%. El porcentaje de masa es el número de gramos de soluto en 100 gramos de masa de solución. La ecuación que muestra el cálculo del porcentaje en masa es la siguiente:

Relación Molalidad Con Molaridad
La molaridad expresa el número de moles de soluto en un litro de solución. La molaridad se puede convertir en molalidad convirtiendo el volumen de la solución en la masa de la solución. Convertir volumen a masa requiere datos sobre la densidad de la solución (p), que se puede formular de la siguiente manera:

Fracción molar
La fracción molar es una medida de la concentración de una solución que expresa la relación entre el número de moles en una parte de una sustancia y el número total de moles presentes en los componentes de la solución. La fracción molar se divide en 2 partes:
Fracción molar de soluto (Xt)
La fórmula para la fracción molar del soluto (Xt), a saber:

Información:
Xt = fracción molar de soluto
Nt = número de moles de soluto
Np = número de moles de disolvente
Fracción molar de disolvente (Xp)
La fórmula para la fracción molar del solvente (Xp), a saber:

Información
Xp = fracción molar de solvente
Nt = número de moles de soluto
Np = número de moles de disolvente
La suma de las fracciones molares de soluto y solvente es 1
xt + xp = 1
Ejemplos de problemas y soluciones de molalidad
Problema 1
¿Cuál es la molalidad de una solución que contiene 4 g de NaOH (Ar Na = 23 g/mol, Ar O = 16 g/mol y Ar H = 1 g/mol) disueltos en 250 g de agua?
Terminación:
Es conocida:
masa de NaOH = 4 gr
ArNa = 23 gr/mol
ArO = 16 g/mol
ArH = 1 gr/mol
masa de agua = 250 gr = 0,25 kg
Preguntado: m = ?
Respuesta:
Señor. NaOH = 40 gr/mol
número de moles de NaOH = masa/Mr
número de moles de NaOH = 4 gr/(40 gr/mol)
número de moles de NaOH = 0,1 mol
m = número de moles/p
m = 0,1 moles / 0,25 kg
metro = 0,4 metros
Problema 2
¿Cuál es la molalidad de una solución de HCl al 37 % (p/p)? (ArH = 1 g/mol, ArCl = 35,5 g/mol)
Terminación:
Es conocida:
masa de HCl = 37%
ArH = 1 g/mol
ArCl = 35,5 g/mol
Preguntado: m = ?
Respuesta:
Señor. HCl = 36,5 gr/mol
Supongamos que la masa de la solución es de 100 gramos, entonces la masa de HCl es:
HCl masa = 37% x 100 gr
masa de HCl = 37 gr
masa de disolvente = masa de solución – masa de HCl
masa de disolvente = 100 gr – 37 gr
masa de disolvente = 63 gr = 0,063 kg
número de moles de HCl = masa/Mr
número de moles de HCl = 37 gr /(36,5 gr/mol)
número de moles de HCl = 1,01 moles
m = número de moles/masa de disolvente
m = 1,01 mol/0,063 kg
m = 16,03 m
Problema 3
Determine la molalidad de la solución preparada al disolver 12 gramos de urea CO(NH2)2 en 250 gramos de agua.
Terminación:
Es conocida:
masa de urea = 12 gr
Señor Urea = 60 g/mol
masa de disolvente = 250 gr = 0,25 kg
Preguntado: m = ?
Anuncio
Respuesta:
número de moles de urea = masa/señor
número de moles de Urea = 12 gr /(60 g/mol)
número de moles de urea = 0,2 moles
m = número de moles/masa de disolvente
m = 0,2 moles / 0,25 kg
metro = 0,8 metros
Problema 4
¿Cuál es la molalidad de una solución alcohólica que contiene 23% en masa de etanol (Mr = 46)?
Respuesta:
Es conocida:
masa de etanol = 23%
Señor etanol = 46 g/mol
Preguntado: m = ?
Terminación:
por ejemplo, la masa de la solución de alcohol es de 100 gramos, entonces la masa de etanol es:
masa de etanol = 23% x 100 gr
masa de etanol = 23 gr
masa de disolvente = masa de solución – masa de etanol
masa de disolvente = 100 gr – 23 gr
masa de disolvente = 77 gr = 0,077 kg
número de moles de etanol = masa/Sr
número de moles de etanol = 23 gr /(46 g/mol)
número de moles de etanol = 0,5 mol
m = número de moles/masa de disolvente
m = 0,5 mol/0,077 kg
m = 6,49 m
Problema 5
Calcule la concentración (% en masa) de glucosa en una solución de glucosa 2 molal.
Terminación:
Es conocida:
m = 2 molal = 2 mol/kg = 0,002 mol/gr
Mr glucosa = 180 gr/mol
Preguntó: masa de glucosa (%) = ?
Respuesta:
moles de glucosa = masa/Sr
moles de glucosa = masa de glucosa/(180 g/mol)
moles de glucosa = masa de glucosa x 0,005 mol/gr
Sustituye los moles de glucosa en la siguiente ecuación:
m = moles de glucosa/masa de disolvente
0,002= masa de glucosa x 0,005/masa de disolvente
o, oo2/o, oo5 = masa de glucosa/masa de disolvente
2/5 = masa de glucosa/masa de disolvente
Entonces, la relación de masa de glucosa: masa de solvente = 2: 5, mientras que la relación de masa de glucosa: masa de solución = 2: 7.
Entonces,
% masa de glucosa = (masa de glucosa/masa de solución) x100%
% en masa de glucosa = (2/7) x 100%
% masa de glucosa = 28,57 %
Problema 6
¿Cuál es la molalidad de una solución que contiene 8 g de NaOH (Ar Na = 23 g/mol, Ar O = 16 g/mol y Ar H = 1 g/mol) disueltos en 250 g de agua?
Discusión
Es conocida:
Masa de NaOH = 8 gr
ArNa = 23 gr/mol
ArO = 16 g/mol
ArH = 1 gr/mol
masa de agua = 250 gr = 0,25 kg
Se busca: Molalidad (m)….?
Respuesta:
Señor. NaOH = 40 gr/mol
El número de moles de NaOH = masa/Sr.
Número de moles de NaOH = 8 gr/(40 gr/mol)
El número de moles de NaOH = 0,2 mol
m = número de moles/p
m = 0,2 moles / 0,25 kg
metro = 0,8 metros
Problema 6
Determine la molalidad de la solución preparada al disolver 15 gramos de urea CO(NH2)2 en 250 gramos de agua.
Discusión
Es conocida:
Masa de urea = 15 gr
Señor Urea = 60 g/mol
Masa de disolvente = 250 gr = 0,25 kg
Se busca: Molalidad (m)…. ?
Respuesta:
Número de moles de Urea = masa/Sr.
Moles totales de Urea = 15 gr / 60 g/mol
El número de moles de Urea = 0,25 mol
m = número de moles/masa de disolvente
m = 0,25 moles / 0,25 kg
metro = 1 metro
Problema 7
¿Cuál es la molalidad de una solución de HCl al 37 % (p/p)? (Ar H = 1 g/mol, Ar Cl = 35,5 g/mol).
Discusión
Es conocida:
masa de HCl = 37%
ArH = 1 g/mol
ArCl = 35,5 g/mol
Se busca: Molalidad (m)…?
Respuesta:
Señor. HCl = 36,5 gr/mol
Supongamos que la masa de la solución es de 100 gramos, entonces la masa de HCl es:
HCl masa = 37% x 100 gr
masa de HCl = 37 gr
masa de disolvente = masa de solución – masa de HCl
masa de disolvente = 100 gr – 37 gr
masa de disolvente = 63 gr = 0,063 kg
número de moles de HCl = masa/Mr
número de moles de HCl = 37 gr /(36,5 gr/mol)
número de moles de HCl = 1,01 moles
m = número de moles/masa de disolvente
m = 1,01 mol/0,063 kg
m = 16,03 m

Problema 8
Determine la cantidad (gramos) de NaOH que debe disolverse en 1 litro de agua (agua = 1,00 g/mL) para obtener 0,25 m de NaOH.
Discusión
Es conocida:
1 L de agua = 1000 mL = 1000 g (ya que ρ de agua = 1,00 g/mL)
mNaOH = 0,25 m
Señor NaOh = 40
Preguntó: gr…?
Respuesta:
mNaOH = gr / Mr x 1.000 / P
0,25 = g/40 x 1000/1000
0,25 = g/40
gramo = 0,25 x 40
gramo = 10 gramos
Entonces, la cantidad de NaOH necesaria es de 10 gramos.
Problema 9
Determine cuántos mL de agua se necesitan para disolver 4,9 gramos de H2SO4 cuya concentración es 0,25 M (Ar H = 1; S = 32; O =16)!
Discusión
Es conocida:
mH2SO4 = 0,25
Sr. H2SO4 = 98
gr = 4,9 gramos
Preguntado :p???
Respuesta:
m = gr/Señor x 1.000/P
0,25 = 4,9/98 x 1000/p
p = 20 gramos (20 mL)
Entonces, el volumen de agua es de 20 mL.
Problema 10
¿Qué masa de agua se requiere para preparar una solución de 1,2 m usando 0,6 mol de NaCl?
Discusión
molalidad (m) = 1,2 mm =
nortePAG
1,2 =
0,6PAG
P=
0,61,2
= 0,5 kg
Entonces, la masa de agua (masa de solvente) requerida es de 0.5 kg
Problema 11
Suponga que hay 2 moles de soluto disueltos en 1 litro de solvente, ¿cuál es la molalidad?
Discusión
moles disueltos (n) = 2 molm =
nortePAG
metro =
21
= 2m
Calcular la molalidad de 25 gramos de KBr (Mr = 119) disueltos en 750 mL de agua pura.
Discusión
soluto = 25 gramos
señor = 119
solvente (P) = 750 mL = 750 gramos (porque ρ de agua = 1.00 g/mL) = 0.75 kgn =
sustancia disueltaSeñor
norte =
25119
= 0,21 moles
metro =
nortePAG
metro =
0,210,75
= 0,28 metros
Así la revisión de Sobre el conocimiento.co.id acerca de Ejemplo de un problema de molalidad , con suerte puede agregar a su visión y conocimiento. Gracias por visitarnos y no olvides leer otros artículos.
Lista de contenidos
Recomendación:
- La Celulosa Es: Definición, Tipo, Estructura, Propiedades y… La celulosa es: definición, tipo, estructura, propiedades y funciones - La celulosa es un compuesto similar a la fibra y se encuentra en las paredes celulares protectoras de las plantas. Para entender mejor, por supuesto discutiremos…
- √ Definición de Expansión en Longitud, Fórmula, Área y Volumen de Sustancia… Definición de expansión larga, fórmulas, área y volumen de sólidos: en esta discusión, explicaremos sobre la expansión larga. Que incluye la noción de dilatación larga, fórmulas de dilatación larga, área, volumen de materia...
- Medidas: definición, conversión de unidades de longitud, cómo... Escalera de medición: definición, conversión de unidades de longitud, cómo usar y preguntas de ejemplo: ¿Qué hay en ¿Qué quiere decir con escalera de tamaño y cómo usarla?, esta vez el conocimiento.co.id lo hará discutirlo...
- Enlaces Covalentes: Definición, Características, Tipos, Fórmulas… Enlaces Covalentes: Definición, Características, Tipos, Fórmulas Químicas y Propiedades de los Compuestos - ¿Qué es un enlace covalente? En esta ocasión, Seputarknowledge.co.id lo discutirá y, por supuesto, también sobre otras cosas. lo cubrió Dejar…
- Discurso Ambiental: Definición, Finalidad, Características y… Discurso Ambiental: Definición, Propósito, Características y Ejemplos - ¿Cómo se estructura el texto del discurso ambiental? ¿Qué es lo bueno y lo correcto?, en esta ocasión Seputarknowledge.co.id lo discutirá y por supuesto cosas Cual…
- Fórmulas de conos, características, propiedades, elementos y ejemplos de problemas. Fórmulas, características, propiedades, elementos y ejemplos de conos Problema: cómo calcular el área y el volumen de una forma cone space?, en esta ocasión Seputarknowledge.co.id hablará de ello y por supuesto de otras cosas Cual…
- Fórmula de Viscosidad: Definición de Viscosidad, Coeficiente y… Fórmula de Viscosidad: Definición de Viscosidad, Coeficiente y Factores que Influyen - Cómo es la Fórmula de Viscosidad La viscosidad es una medida de la resistencia de un fluido que cambia por estrés o por presión. En esta ocasión, Seputarknowledge.co.id…
- Unidad de Peso: Definición, Escala de Conversión y Ejemplos… Unidad de Peso: Definición, Escalera de Conversión y Problema Ejemplo - ¿Qué es una Unidad de Peso?, en esta ocasión Sobre el conocimiento.co.id lo discutirá, incluida la comprensión y, por supuesto, también otras cosas. lo cubrió Dejar…
- Momento de Inercia: Definición, Factores, Ecuaciones de Formas… Momento de inercia: definición, factores, ecuaciones en forma de objetos y problemas de ejemplo: qué significa con el Momento de Inercia?, en esta ocasión, Se hablará sobre el conocimiento.co.id y por supuesto sobre asunto…
- Movimiento circular uniformemente cambiante: definición, magnitud... Movimiento circular uniformemente cambiante: definición, cantidad física, fórmulas y ejemplos de problemas - ¿Qué es el movimiento? ¿Cambios circulares regulares y ejemplos? En esta ocasión, Seputarknowledge.co.id lo discutirá y por supuesto sobre...
- Integral Indefinida: Definición, Fórmulas, Propiedades y Ejemplos… Integral Indefinida: Definición, Fórmulas, Propiedades y Ejemplos de Problemas - Qué se entiende por Integral Indefinida Por supuesto y cómo calcular las operaciones matemáticas? voluntad…
- Definición de Métodos de Aprendizaje: Características, Propósito, Tipos y… Definición de Métodos de Aprendizaje: Características, Propósito, Tipos y Discusión - Qué se entiende por Método ¿Aprender?, en esta ocasión Seputarknowledge.co.id hablará de ello y por supuesto de otras cosas También…
- Equilibrio químico: definición, leyes, fórmulas, problemas de ejemplo Equilibrio químico: definición, leyes, fórmulas, problemas de ejemplo: en esta discusión explicaremos sobre equilibrio químico, ley de fórmula y equipado con ejemplos de equilibrio químico con completa y ...
- Soluciones Ácido-Base: Definición, Teoría Ácido-Base, Propiedades y… Soluciones ácido-base: definición, teoría ácido-base, propiedades y tipos: las soluciones ácidas y básicas son dos grupos de compuestos químicos que se encuentran y usan ampliamente en la vida cotidiana.
- Espacio de construcción: definición, fórmulas y varios ... Construir Espacio – Definición, Fórmulas y sus Diversos Tipos - En esta ocasión, nos gustaría repasar material matemático sobre formas geométricas, tanto en términos de comprensión como otros. Inmediatamente, hablemos...
- √ Indicador ácido-base: definición, tipos y ejemplos Indicadores Ácido-Base: Definición, Tipos y Ejemplos - En esta ocasión, Around Knowledge hablará sobre los Indicadores Ácido-Base. Lo cual en esta discusión explica el significado de indicador ácido...
- Ley de Boyle: Definición, Fórmulas, Aplicaciones y Ejemplos… Ley de Boyle: definición, fórmulas, aplicaciones y ejemplos de problemas: en esta discusión explicaremos sobre la ley de Boyle. Que incluye el significado de la ley de Boyle, la fórmula de la ley de Boyle, la aplicación de…
- Cuentos motivacionales: definición, consejos de escritura y ejemplos Cuentos Motivacionales: Definición, Consejos de Escritura y Ejemplos - ¿Qué es un Cuento Motivacional?, En En esta ocasión, Seputarknowledge.co.id discutirá si se trata del cuento de la Amistad y otros asuntos sobre eso Vamos a ver…
- Definición de presión: tipos de presión, fórmulas y problemas de ejemplo Definición de Presión: Tipos de Presión, Fórmulas y Ejemplos de Problemas - ¿Qué es Presión? En esta ocasión, alrededor del conocimiento.co.id, discutiremos qué es la presión y qué otros elementos son. lo cubrió Vamos a ver…
- Fluidos Dinámicos: Tipos, Características, Ecuación de Bernoulli, Teoremas… Fluidos Dinámicos: Tipos, Propiedades, Ecuación De Bernoulli, Teorema De Toricelli, Fórmulas Y Ejemplos De Problemas - Qué Es ¿Fluidos dinámicos y sus tipos? acerca de…
- Densidad del agua: definición, fórmulas y ejemplos Densidad del agua: definición, fórmulas y ejemplos - ¿Cuál es la densidad del agua? Veamos juntos…
- Definición de Cantidad, Unidad, Medida y Ejemplos… Definición de Cantidad, Unidad, Medida y Ejemplos (Completo) - En conceptos básicos de física, seguramente nos han introducido en algo relacionado con la vida cotidiana. Como medir altura, pesar masa, medir ancho,...
- Ejemplos de trabajo científico: funciones y reglas del lenguaje Ejemplos de artículos científicos: funciones y reglas del lenguaje - ¿Cuáles son ejemplos de formas buenas y correctas de escribir artículos científicos? Previamente, Seputar el conocimiento.co.id ha discutido Trabajo Científico: Definición, Características, Beneficios,…
- Ejemplos de formas planas: tipos, características y fórmulas de formas planas Ejemplos de formas planas: tipos, propiedades y fórmulas de formas planas - ¿Cuáles son los ejemplos de formas planas?
- Ejemplos de preguntas de educación física para la clase 11 (XI) SMA/MA/SMK Semestre 1 y 2 Ejemplos de Preguntas de Educación Física para Clase 11 (XI) para SMA/MA/SMK Semestre 1 y 2 (2019 y 2020) - En esta ocasión, Seputarknowledge.co.id discutirá ejemplos de Preguntas de Educación Física para Clase 11 de Opción Múltiple y Ensayo ...
- Precipitación es: 12 Definiciones Según Expertos, Tipos,… La precipitación es: 12 definiciones según los tipos de expertos y factores: en esta discusión, Around Knowledge explicará sobre la precipitación. La precipitación es un evento climático que es natural,...
- √ Definición de Compuestos Químicos, Características, Tipos y Nomenclatura… Definición de Compuestos Químicos, Características, Tipos, Nomenclatura Completa - En esta discusión explicaremos sobre los Compuestos Químicos. Cubre la definición, características, tipos y nomenclatura de compuestos químicos con discusión...
- Las sustancias individuales son: definición, elementos y compuestos Las Sustancias Individuales Son: Definiciones, Elementos y Compuestos - ¿Qué significa una sustancia individual? Veamos la discusión juntos...
- Plano Inclinado: Definición, Fórmulas, Ventaja Mecánica Y… Plano Oblicuo: Definición, Fórmulas, Ventajas Mecánicas y Ejemplos de Problemas - Qué se entiende por plano oblicua y cómo calcular la física? naturalmente…
- Conversión de Unidades: Definición, Factor, Longitud, Masa, Tiempo,… Conversión de Unidades: Definición, Factor, Longitud, Masa, Tiempo, Volumen y Presión - ¿Qué es la conversión de unidades?, En esta ocasión, Seputarknowledge.co.id lo discutirá, incluyendo factores, tipos y, por supuesto, otras cosas. Cual…
