Αριθμοί οξείδωσης: Ορισμός, κανόνες προσδιορισμού και παραδείγματα προβλημάτων
Αριθμοί οξείδωσης: Ορισμός, κανόνες προσδιορισμού και παραδείγματα προβλημάτων - Τι είναι ο αριθμός οξείδωσης και ένα παράδειγμα; Σ'αυτή την περίπτωση Σχετικά με το Knowledge.co.id θα το συζητήσουμε και φυσικά για άλλα πράγματα που το περιβάλλουν επίσης.
Ας ρίξουμε μια ματιά στη συζήτηση στο παρακάτω άρθρο για να την κατανοήσουμε καλύτερα
Πίνακας περιεχομένων
-
Αριθμοί οξείδωσης: Ορισμός, κανόνες προσδιορισμού και παραδείγματα προβλημάτων
- Κανόνες για τον προσδιορισμό της οξείδωσης
- Παραδείγματα αριθμών οξείδωσης
- Μοιραστείτε αυτό:
- Σχετικές αναρτήσεις:
Αριθμοί οξείδωσης: Ορισμός, κανόνες προσδιορισμού και παραδείγματα προβλημάτων
Ο αριθμός οξείδωσης ή η κατάσταση οξείδωσης είναι ο αριθμός των αρνητικών και θετικών φορτίων σε ένα άτομο, το οποίο υποδηλώνει έμμεσα τον αριθμό των ηλεκτρονίων που έχουν γίνει αποδεκτά ή έχουν δοθεί σε άλλα άτομα. Μερικά άτομα έχουν μόνο μία κατάσταση οξείδωσης, αλλά μερικά άτομα έχουν περισσότερες από μία κατάσταση οξείδωσης.
Εάν βρείτε την τιμή ενός ατομικού αριθμού σε ένα μόριο ή ένωση, τότε πρέπει πρώτα να γνωρίζετε την κατάσταση οξείδωσης των ατόμων άλλων στοιχείων που έχουν γενικές (τυπικές) ιδιότητες.
Κανόνες για τον προσδιορισμό της οξείδωσης
Για να προσδιορίσετε τον αριθμό οξείδωσης (Biloks) σε ένα ιόν ή άλλες ενώσεις πρέπει να ακολουθείτε τους παρακάτω κανόνες:
-
Η κατάσταση οξείδωσης ενός ελεύθερου στοιχείου με τη μορφή ατόμου ή μορίου ενός στοιχείου έχει τιμή 0 (μηδέν).
Τα ελεύθερα στοιχεία με τη μορφή ατόμων είναι:
- Η κατάσταση οξείδωσης του C στο C είναι = 0
- Η κατάσταση οξείδωσης του Ca σε Ca είναι = 0
- Η κατάσταση οξείδωσης του Cu στο Cu είναι = 0
- Η κατάσταση οξείδωσης του Na σε Na είναι = 0
- Η κατάσταση οξείδωσης του Fe σε Fe είναι = 0
- Ο αριθμός οξείδωσης του Al σε Al είναι = 0
- Η κατάσταση οξείδωσης του Ne σε Ne είναι ίση με 0
Τα ελεύθερα στοιχεία με τη μορφή μορίων είναι:
- Η κατάσταση οξείδωσης Η του Η2 είναι = 0
- Η κατάσταση οξείδωσης του Ο σε O2 είναι = 0
- Η κατάσταση οξείδωσης του Cl σε Cl2 είναι = 0
- Η κατάσταση οξείδωσης του P σε P4 είναι = 0
- Η κατάσταση οξείδωσης S στο S8 είναι = 0
-
Η κατάσταση οξείδωσης ενός μετάλλου σε μια ένωση είναι πάντα θετική.
Στην ομάδα 1 μεταλλικά στοιχεία (παλιό σύστημα Gol. IA) (Li, Na, K, Rb, Cs, Fr), η κατάσταση οξείδωσης είναι +1.
- Η κατάσταση οξείδωσης του Κ σε KCl, KNO3 ή K2SO4 είναι = +1
Στην ομάδα 2 μεταλλικά στοιχεία (παλιά ομάδα συστήματος. IIA) (Be, Mg, Ca, Sr, Ba, Ra), η κατάσταση οξείδωσης είναι +2.
- Η κατάσταση οξείδωσης του Mg σε MgO, MgCl2 ή MgSO4 είναι = +2
Οι αριθμοί οξείδωσης (Biloks) άλλων μεταλλικών στοιχείων είναι:
- Το Ag αξίζει = +1
- Το Cu αξίζει = +1 και +2
- Hg αξίζει = +1 και +2
- Το Au αξίζει = +1 και +3
- Το Fe αξίζει = +2 και +3
-
Οι αριθμοί οξείδωσης (Bilox) των μονοατομικών ιόντων (για 1 άτομο) και των πολυατομικών ιόντων (περισσότερα από 1 άτομα) είναι οι ίδιοι στο φορτίο των ιόντων.
-
Οι καταστάσεις οξείδωσης των μονοτομικών ιόντων είναι Na +, Ca2 +, Al3 +, Cl– και 02- αντίστοιχα + 1, + 2, +3, -1 και -2.
- Οι καταστάσεις οξείδωσης των πολυατομικών ιόντων είναι NH4 +, SO42-, PO43-, αντίστοιχα +1, -2 και -3.
-
-
Ο αριθμός οξείδωσης των στοιχείων ομάδας VIA (O, S, Se, Te, Po) σε δυαδικές ενώσεις είναι -2 και τα στοιχεία ομάδας VIIA (F, Cl, Br, I, At) σε δυαδικές ενώσεις είναι -1.
-
Η κατάσταση οξείδωσης του στοιχείου S σε Na2S και MgS είναι = -2.
- Η κατάσταση οξείδωσης του στοιχείου Cl σε NaCl, KCl, MgCl2 και FeCl3 είναι = -1.
-
-
Ο αριθμός οξείδωσης του στοιχείου Η στις ενώσεις του είναι = +1.
Εκτός από την κατάσταση οξείδωσης των υδριδίων (ενώσεις υδρογόνου με μέταλλα) η τιμή = -1.
Επειδή στα υδρίδια, το υδρογόνο υπάρχει με τη μορφή του ιόντος υδριδίου, H–. Η κατάσταση οξείδωσης ενός ιόντος όπως ένα υδρίδιο είναι η ίδια με το φορτίο ενός ιόντος, που είναι = -1.
- Η κατάσταση οξείδωσης του στοιχείου Η σε H2O, HCl, H2S και NH3 είναι = +1.
- Ο αριθμός οξείδωσης του στοιχείου Η σε NaH, CaH2 και AlH3 είναι = -1.
-
Ο αριθμός οξείδωσης του στοιχείου Ο στην ένωση του είναι -2, εκτός,
-
Ο αριθμός οξείδωσης μιας δυαδικής ένωσης στο F είναι = +2.
- Η κατάσταση οξείδωσης των ενώσεων υπεροξειδίου, όπως H2O2, Na2O2 και BaO2, είναι = -1.
- Η κατάσταση οξείδωσης των υπεροξειδίων, όπως το ΚΟ2 και το Na02, είναι = -½.
- Ο αριθμός οξείδωσης (Biloks) του στοιχείου O σε H2O, KOH, H2SO4 και Na3PO4 είναι -2
-
-
Το άθροισμα των αριθμών οξείδωσης των στοιχείων σε μια ένωση είναι 0 (μηδέν).
Το άθροισμα ενός αριθμού οξείδωσης στοιχείων που σχηματίζουν ιόντα ή πολυατομικές ενώσεις είναι ίσο με το φορτίο στο ίδιο το πολυατομικό ιόν.
-
Ο αριθμός οξείδωσης του οξυγόνου (O) στην ένωση υπεροξειδίου = -1. Αριθμός οξείδωσης Ο σε ενώσεις μη υπεροξειδίου = -2.
Παράδειγμα:
O κατάσταση οξείδωσης σε BaO2 = -1.
Το άτομο Ba είναι ένα μεταλλικό στοιχείο ομάδας IIA, έτσι η κατάσταση οξείδωσης του Ba = +2. Το άθροισμα των καταστάσεων οξείδωσης των Ba και O πρέπει να είναι 0 (το σημείο 6 του κανόνα οξείδωσης). Επομένως, η κατάσταση οξείδωσης του Ο πρέπει να είναι -2. Επειδή το άτομο Ο έχει δείκτη 2, έτσι η κατάσταση οξείδωσης Ο: δείκτης Ο = -2: 2 = -1. Αποδεικνύεται ότι η κατάσταση οξείδωσης του Ο σε BaO2 είναι -1.
Παραδείγματα αριθμών οξείδωσης
Παράδειγμα Ερώτηση 1
Προσδιορίστε τον αριθμό οξείδωσης των στοιχείων με έντονη γραφή στις ακόλουθες ενώσεις:
- Ν2Ο5
- ΜΝΟ4–
- Αλ2(ΕΤΣΙ4)3
Απάντηση:
Η κατάσταση οξείδωσης θα καθοριστεί, για παράδειγμα x:
- 1. Φόρτιση Ν2Ο5 δηλ. (2 x κατάσταση οξείδωσης του N) + (5 x κατάσταση οξείδωσης του O)
0 = (2x (x)) + (5 x (-2))
0 = 2x - 10
x = +5
Έτσι, ο αριθμός οξείδωσης του ατόμου Ν στην ένωση N2O5 είναι +5
- 2. Χρέωση MnO4– είναι (1 x αριθμός οξείδωσης Mn) + (4 x κατάσταση οξείδωσης του O) ως εξής!
-1 είναι (1 x (x)) + (4 x (-2))
-1 είναι x - 8
το x είναι +7
Έτσι, ο αριθμός οξείδωσης του ατόμου Mn στην ένωση MnO είναι4– δηλαδή +7
- 3. Al φορτίο2(ΕΤΣΙ4)3 = (2 x κατάσταση οξείδωσης Al) + (3 x κατάσταση οξείδωσης του S) + (12 x κατάσταση οξείδωσης του O), είναι:
0 = (2 x (+3)) + (3 x (x)) + (12 x (-2))
0 = 6 + 3x -24
x = +6
Έτσι, ο αριθμός οξείδωσης του ατόμου S στην ένωση ΑΙ είναι2(ΕΤΣΙ4)3 δηλαδή +6.
Παράδειγμα Ερώτηση 2
Αμέσως για το παράδειγμα προβλήματος στους αριθμούς οξείδωσης, ότι στο «Ποιος είναι ο αριθμός οξείδωσης του ατόμου C στον αριθμό οξείδωσης στο CH4 με τον κανόνα αριθμού οξείδωσης H = +1;
Απάντηση:
Oxx of H x Αριθμός ατόμων H = + '1 x 4 = +4
Oxx C x Αριθμός ατόμων C = a x 1 = a
Εάν παρατηρηθεί από την ένωση είναι ουδέτερη ένωση, τότε ο αριθμός των καταστάσεων οξείδωσης των στοιχείων σε αυτήν πρέπει να είναι μηδέν, που σημαίνει:
a + (+4) = O
α = -4
Έτσι ο αριθμός οξείδωσης του C στην ένωση CH4 είναι -4.
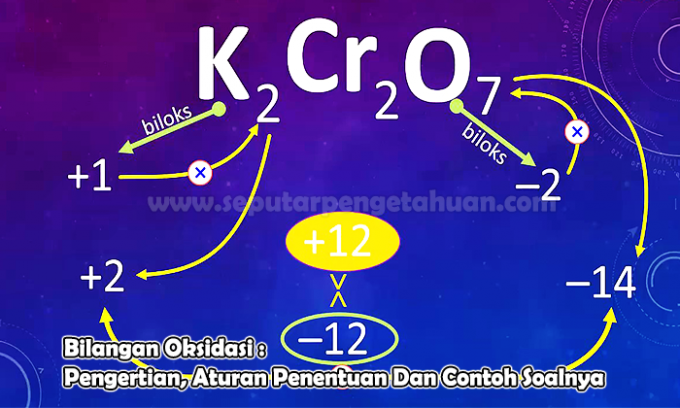
Παράδειγμα Ερώτηση 3
Προσδιορίστε τον αριθμό οξείδωσης του στοιχείου N στις ακόλουθες ενώσεις:
Ν2Ο5
Απάντηση:
Η κατάσταση οξείδωσης θα σημειωθεί με Χ
Φόρτιση Ν2Ο5 δηλ. (2 x κατάσταση οξείδωσης του N) + (5 x κατάσταση οξείδωσης του O)
0 = (2 x (x)) + (5 x (-2))
0 = 2x - 10
x = +5
Έτσι, ο αριθμός οξείδωσης του ατόμου Ν στην ένωση Ν2Ο5 δηλαδή +5.
Αυτή είναι η κριτική από Σχετικά με το Knowledge.co.id σχετικά με Αριθμοί οξείδωσης: Ορισμός, κανόνες προσδιορισμού και παραδείγματα προβλημάτων, Ας ελπίσουμε ότι μπορεί να προσθέσει τις γνώσεις και τις γνώσεις σας Σας ευχαριστούμε που επισκεφθήκατε και μην ξεχάσετε να διαβάσετε άλλα άρθρα.
Διαβάστε επίσης:BMKG: Ορισμός, Ιστορία, Θέση και Δραστηριότητες
