Παράδειγμα προβλήματος μοριακότητας: Μοριακό κλάσμα, τύπος και λύση
Παράδειγμα προβλήματος μοριακότητας: Μοριακό κλάσμα, τύπος και λύση - Σ'αυτή την περίπτωση Σχετικά με τη γνώση.co.id θα συζητήσει το molality με αρκετά παραδείγματα ερωτήσεων και φυσικά για άλλα πράγματα που επίσης την καλύπτουν. Ας δούμε μαζί τη συζήτηση στο παρακάτω άρθρο για να την κατανοήσουμε καλύτερα.
Παράδειγμα προβλήματος μοριακότητας: Μοριακό κλάσμα, τύπος και λύση
Μοριακότητα ή μοριακή συγκέντρωση είναι ένα μέτρο της συγκέντρωσης μιας διαλυμένης ουσίας σε ένα διάλυμα ως προς την ποσότητα της ουσίας σε μια ορισμένη μάζα του διαλύτη. Αυτό είναι διαφορετικό από τον ορισμό της μοριακότητας που βασίζεται σε έναν ορισμένο όγκο διαλύματος.
Η κοινή μονάδα μοριακότητας στη χημεία είναι mol/kg. Ένα διάλυμα με συγκέντρωση 1 mol/kg εκφράζεται επίσης μερικές φορές ως 1 molal. Ο όρος μοριακότητα σχηματίζεται σε αναλογία με τη μοριακότητα που είναι η μοριακή συγκέντρωση ενός διαλύματος.
Η μοριακότητα ενός διαλύματος μπορεί να ελεγχθεί με την προσθήκη κάποιου διαλύτη. Πιο απλά, το Molality (m) ενός διαλύματος είναι τα mol της διαλυμένης ουσίας διαιρούμενα με τα κιλά του διαλύτη. Molality ή molality είναι η συγκέντρωση ενός διαλύματος που δηλώνει τον αριθμό των mol (n) διαλυμένης ουσίας σε 1 kg ή 1000 γραμμάρια διαλύτη.
Η διαφορά μεταξύ μοριακότητας και μοριακότητας είναι ότι αν η μοριακότητα είναι μοριακότητα ή η μοριακή συγκέντρωση (m) εκφράζει τον αριθμό των γραμμομορίων διαλυμένη ουσία σε 1000 γραμμάρια διαλύτη ενώ η μοριακότητα είναι μια δήλωση του αριθμού των γραμμομορίων διαλυμένης ουσίας σε κάθε λίτρο λύση. Η μοριακότητα αντιπροσωπεύεται από τον συμβολισμό M και οι μονάδες είναι moles/λίτρο.
Τύπος Molality
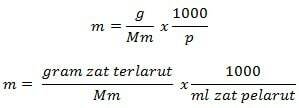
Πληροφορίες
m = μοριακότητα (mol/kg)
g = γραμμάρια διαλυμένης ουσίας (g)
Mm = μοριακή μάζα ουσίας (g/mol)
P = μάζα διαλύτη (g)
Μοριακή σχέση με το ποσοστό μάζας
Το ποσοστό μάζας είναι μια μονάδα συγκέντρωσης που χρησιμοποιείται συνήθως σε χημικά διαλύματα. Παραδείγματα διαλυμάτων που μπορούμε να βρούμε καθημερινά είναι διάλυμα αλκοόλης 75% και διάλυμα οξικού οξέος 24%. Το ποσοστό μάζας είναι ο αριθμός των γραμμαρίων διαλυμένης ουσίας σε 100 γραμμάρια μάζας διαλύματος. Η εξίσωση που δείχνει τον υπολογισμό του ποσοστού μάζας είναι η εξής:

Σχέση Molality με Molarity
Η μοριακότητα εκφράζει τον αριθμό των γραμμομορίων διαλυμένης ουσίας σε ένα λίτρο διαλύματος. Η μοριακότητα μπορεί να μετατραπεί σε μοριακότητα μετατρέποντας τον όγκο του διαλύματος στη μάζα του διαλύματος. Η μετατροπή του όγκου σε μάζα απαιτεί δεδομένα σχετικά με την πυκνότητα του διαλύματος (p), τα οποία μπορούν να διατυπωθούν ως εξής:

Γραμμομοριακό κλάσμα
Το μοριακό κλάσμα είναι ένα μέτρο της συγκέντρωσης ενός διαλύματος που εκφράζει την αναλογία του αριθμού των γραμμομορίων σε ένα μέρος μιας ουσίας προς τον συνολικό αριθμό γραμμομορίων που υπάρχουν στα συστατικά του διαλύματος. Το μοριακό κλάσμα χωρίζεται σε 2 μέρη:
Μοριακό κλάσμα διαλυμένης ουσίας (Xt)
Ο τύπος για το μοριακό κλάσμα της διαλυμένης ουσίας (Xt), δηλαδή:

Πληροφορίες:
Xt = μοριακό κλάσμα διαλυμένης ουσίας
Nt = αριθμός γραμμομορίων διαλυμένης ουσίας
Np = αριθμός γραμμομορίων διαλύτη
Μοριακό κλάσμα διαλύτη (Xp)
Ο τύπος για το μοριακό κλάσμα του διαλύτη (Xp), δηλαδή:

Πληροφορίες
Xp = μοριακό κλάσμα διαλύτη
Nt = αριθμός γραμμομορίων διαλυμένης ουσίας
Np = αριθμός γραμμομορίων διαλύτη
Το άθροισμα των μοριακών κλασμάτων της διαλυμένης ουσίας και του διαλύτη είναι 1
Xt + Xp = 1
Παραδείγματα Προβλημάτων Μοραλικότητας και Λύσεων
Πρόβλημα 1
Ποια είναι η μοριακότητα ενός διαλύματος που περιέχει 4 g NaOH (Ar Na = 23 g/mol, Ar O = 16 g/mol και Ar H = 1 g/mol) διαλυμένο σε 250 g νερού;
Ολοκλήρωση:
Είναι γνωστό:
μάζα NaOH = 4 gr
ArNa = 23 gr/mol
ArO = 16 g/mol
ArH = 1 gr/mol
μάζα νερού = 250 gr = 0,25 kg
Ερωτήθηκε: m = ?
Απάντηση:
Κύριος. NaOH = 40 gr/mol
αριθμός mol NaOH = μάζα/Mr
αριθμός mol NaOH = 4 gr/(40 gr/mol)
αριθμός mol NaOH = 0,1 mol
m = αριθμός κρεατοελιών/p
m = 0,1 mol / 0,25 kg
m = 0,4 m
Πρόβλημα 2
Ποια είναι η μοριακότητα ενός διαλύματος HCl 37% (w/w); (Ar H = 1 g/mol, Ar Cl = 35,5 g/mol)
Ολοκλήρωση:
Είναι γνωστό:
μάζα HCl = 37%
ArH = 1 g/mol
ArCl = 35,5 g/mol
Ερωτήθηκε: m = ?
Απάντηση:
Κύριος. HCl = 36,5 gr/mol
Ας υποθέσουμε ότι η μάζα του διαλύματος είναι 100 γραμμάρια, τότε η μάζα του HCl είναι:
Μάζα HCl = 37% x 100 γρ
μάζα HCl = 37 γρ
μάζα διαλύτη = μάζα διαλύματος – μάζα HCl
μάζα διαλύτη = 100 gr – 37 gr
μάζα διαλύτη = 63 gr = 0,063 kg
αριθμός γραμμομορίων HCl = μάζα/κ
αριθμός mol HCl = 37 gr /(36,5 gr/mol)
αριθμός mol HCl = 1,01 moles
m = αριθμός mol/μάζα διαλύτη
m = 1,01 mol /0,063 kg
m = 16,03 m
Πρόβλημα 3
Προσδιορίστε τη μοριακότητα του διαλύματος που παρασκευάστηκε με τη διάλυση 12 γραμμαρίων ουρίας CO(NH2)2 σε 250 γραμμάρια νερού.
Ολοκλήρωση:
Είναι γνωστό:
μάζα ουρίας = 12 γρ
Mr Urea = 60 g/mol
μάζα διαλύτη = 250 gr = 0,25 kg
Ερωτήθηκε: m = ?
Διαφήμιση
Απάντηση:
αριθμός moles ουρίας = μάζα/κ
αριθμός mole ουρίας = 12 gr /(60 g/mol)
αριθμός mole ουρίας = 0,2 moles
m = αριθμός mol/μάζα διαλύτη
m = 0,2 mol / 0,25 kg
m = 0,8 m
Πρόβλημα 4
Ποια είναι η μοριακότητα ενός αλκοολικού διαλύματος που περιέχει 23 % κατά μάζα αιθανόλη (Mr = 46);
Απάντηση:
Είναι γνωστό:
μάζα αιθανόλης = 23%
Mr αιθανόλη = 46 g/mol
Ερωτήθηκε: m = ?
Ολοκλήρωση:
για παράδειγμα η μάζα του διαλύματος αλκοόλης είναι 100 γραμμάρια, τότε η μάζα της αιθανόλης είναι:
μάζα αιθανόλης = 23% x 100 γρ
μάζα αιθανόλης = 23 γρ
μάζα διαλύτη = μάζα διαλύματος – μάζα αιθανόλης
μάζα διαλύτη = 100 gr – 23 gr
μάζα διαλύτη = 77 gr = 0,077 kg
αριθμός γραμμομορίων αιθανόλης = μάζα/κ
αριθμός mol αιθανόλης = 23 gr /(46 g/mol)
αριθμός mol αιθανόλης = 0,5 mol
m = αριθμός mol/μάζα διαλύτη
m = 0,5 mol /0,077 kg
m = 6,49 m
Πρόβλημα 5
Υπολογίστε τη συγκέντρωση (% κατά μάζα) της γλυκόζης σε διάλυμα γλυκόζης 2 mol.
Ολοκλήρωση:
Είναι γνωστό:
m = 2 molal = 2 mol/kg = 0,002 mol/gr
Mr γλυκόζη = 180 gr/mol
Ερωτηθείς: μάζα γλυκόζης (%) = ?
Απάντηση:
mole γλυκόζης = μάζα/κ
mole γλυκόζης = μάζα γλυκόζης/(180 g/mol)
mole γλυκόζης = μάζα γλυκόζης x 0,005 mol/gr
Αντικαταστήστε τα mol της γλυκόζης στην ακόλουθη εξίσωση:
m = mole γλυκόζης/μάζα διαλύτη
0,002= μάζα γλυκόζης x 0,005/μάζα διαλύτη
o, oo2/o, oo5 = μάζα γλυκόζης/μάζα διαλύτη
2/5 = μάζα γλυκόζης/μάζα διαλύτη
Άρα ο λόγος μάζας γλυκόζης: μάζα διαλύτη = 2:5, ενώ ο λόγος μάζας γλυκόζης: μάζα διαλύματος = 2:7.
Ετσι,
% μάζα γλυκόζης = (μάζα γλυκόζης/μάζα διαλύματος) x100%
% κατά μάζα γλυκόζης = (2/7) x 100%
% μάζα γλυκόζης = 28,57 %
Πρόβλημα 6
Ποια είναι η μοριακότητα ενός διαλύματος που περιέχει 8 g NaOH (Ar Na = 23 g/mol, Ar O = 16 g/mol και Ar H = 1 g/mol) διαλυμένο σε 250 g νερού;
Συζήτηση
Είναι γνωστό:
Μάζα NaOH = 8 gr
ArNa = 23 gr/mol
ArO = 16 g/mol
ArH = 1 gr/mol
μάζα νερού = 250 gr = 0,25 kg
Ζητείται: Molality (m)….;
Απάντηση:
Κύριος. NaOH = 40 gr/mol
Ο αριθμός των mol NaOH = μάζα/Mr
Αριθμός γραμμομορίων NaOH = 8 gr/(40 gr/mol)
Ο αριθμός των mol NaOH = 0,2 mol
m = αριθμός κρεατοελιών/p
m = 0,2 mol / 0,25 kg
m = 0,8 m
Πρόβλημα 6
Προσδιορίστε τη μοριακότητα του διαλύματος που παρασκευάστηκε διαλύοντας 15 γραμμάρια ουρίας CO(NH2)2 σε 250 γραμμάρια νερού.
Συζήτηση
Είναι γνωστό:
Μάζα ουρίας = 15 γρ
Mr Urea = 60 g/mol
Μάζα διαλύτη = 250 gr = 0,25 kg
Ζητείται: Molality (m)…. ?
Απάντηση:
Αριθμός moles ουρίας = μάζα/κ
Συνολικά mole Ουρίας = 15 gr / 60 g/mol
Ο αριθμός των mol της Ουρίας = 0,25 mol
m = αριθμός mol/μάζα διαλύτη
m = 0,25 mol / 0,25 kg
m = 1 m
Πρόβλημα 7
Ποια είναι η μοριακότητα ενός διαλύματος HCl 37% (w/w); (Ar H = 1 g/mol, Ar Cl = 35,5 g/mol).
Συζήτηση
Είναι γνωστό:
μάζα HCl = 37%
ArH = 1 g/mol
ArCl = 35,5 g/mol
Ζητείται: Molality (m)…;
Απάντηση:
Κύριος. HCl = 36,5 gr/mol
Ας υποθέσουμε ότι η μάζα του διαλύματος είναι 100 γραμμάρια, τότε η μάζα του HCl είναι:
Μάζα HCl = 37% x 100 γρ
μάζα HCl = 37 γρ
μάζα διαλύτη = μάζα διαλύματος – μάζα HCl
μάζα διαλύτη = 100 gr – 37 gr
μάζα διαλύτη = 63 gr = 0,063 kg
αριθμός γραμμομορίων HCl = μάζα/κ
αριθμός mol HCl = 37 gr /(36,5 gr/mol)
αριθμός mol HCl = 1,01 moles
m = αριθμός mol/μάζα διαλύτη
m = 1,01 mol /0,063 kg
m = 16,03 m

Πρόβλημα 8
Προσδιορίστε την ποσότητα (γραμμάρια) NaOH που πρέπει να διαλυθεί σε 1 λίτρο νερού (νερό = 1,00 g/mL) για να ληφθούν 0,25 m NaOH.
Συζήτηση
Είναι γνωστό:
1 L νερού = 1000 mL = 1000 g (αφού ρ νερού = 1,00 g/mL)
mNaOH = 0,25 m
Mr NaOh = 40
Ρωτήθηκε: gr…?
Απάντηση:
mNaOH = gr / Mr x 1.000 / P
0,25 = gr/40 x 1.000/1.000
0,25 = g/40
g = 0,25 x 40
g = 10 γραμμάρια
Άρα, η ποσότητα του NaOH που χρειάζεται είναι 10 γραμμάρια.
Πρόβλημα 9
Προσδιορίστε πόσα mL νερού χρειάζονται για να διαλυθούν 4,9 γραμμάρια H2SO4 του οποίου η συγκέντρωση είναι 0,25 M (Ar H = 1; S = 32; Ο = 16)!
Συζήτηση
Είναι γνωστό:
mH2SO4 = 0,25
Mr H2SO4 = 98
gr = 4,9 γραμμάρια
Ρωτήθηκε :p???
Απάντηση:
m = gr/Mr x 1.000/P
0,25 = 4,9/98 x 1.000/σελ
p = 20 γραμμάρια (20 mL)
Άρα, ο όγκος του νερού είναι 20 mL.
Πρόβλημα 10
Ποια μάζα νερού απαιτείται για την παρασκευή ενός διαλύματος 1,2 m χρησιμοποιώντας 0,6 mol NaCl;
Συζήτηση
μοριακότητα (m) = 1,2 mm =
nΠ
1,2 =
0,6Π
Ρ=
0,61,2
= 0,5 κιλά
Άρα η απαιτούμενη μάζα νερού (μάζα διαλύτη) είναι 0,5 kg
Πρόβλημα 11
Ας υποθέσουμε ότι υπάρχουν 2 mol διαλυμένης ουσίας διαλυμένα σε 1 λίτρο διαλύτη, ποια είναι η μοριακότητα;
Συζήτηση
διαλυμένα moles (n) = 2 molm =
nΠ
m =
21
= 2μ
Υπολογίστε τη μοριακότητα 25 γραμμαρίων KBr (Mr = 119) διαλυμένα σε 750 mL καθαρού νερού.
Συζήτηση
διαλυμένη ουσία = 25 γραμμάρια
Mr = 119
διαλύτης (P) = 750 mL = 750 γραμμάρια (γιατί ρ νερού = 1,00 g/mL) = 0,75 kgn =
διαλυμένη ουσίακύριος
n =
25119
= 0,21 mol
m =
nΠ
m =
0,210,75
= 0,28 μ
Έτσι η κριτική από Σχετικά με τη γνώση.co.id σχετικά με Παράδειγμα προβλήματος μολικότητας , ελπίζουμε ότι μπορεί να προσθέσει στη διορατικότητα και τις γνώσεις σας. Σας ευχαριστούμε για την επίσκεψη και μην ξεχάσετε να διαβάσετε άλλα άρθρα.
Κατάλογος περιεχομένων
Σύσταση:
- Η κυτταρίνη είναι: ορισμός, τύπος, δομή, ιδιότητες και… Η κυτταρίνη είναι: Ορισμός, τύπος, δομή, ιδιότητες και λειτουργίες - Η κυτταρίνη είναι μια ένωση που μοιάζει με ίνα και βρίσκεται στα προστατευτικά κυτταρικά τοιχώματα των φυτών. Για να καταλάβουμε καλύτερα, φυσικά θα συζητήσουμε…
- √ Ορισμός της επέκτασης στο μήκος, τον τύπο, την περιοχή και τον όγκο της ουσίας… Ορισμός μακράς διαστολής, τύποι, εμβαδόν και όγκος στερεών - Σε αυτή τη συζήτηση θα εξηγήσουμε σχετικά με τη μεγάλη διαστολή. Το οποίο περιλαμβάνει την έννοια της μακράς διαστολής, τους τύπους μακράς διαστολής, το εμβαδόν, τον όγκο της ύλης...
- Μέτρα: Ορισμός, Μετατροπή μονάδας μήκους, Πώς να… Κλίμακα μέτρησης: Ορισμός, μετατροπή μονάδων μήκους, τρόπος χρήσης και παραδείγματα ερωτήσεων - Τι υπάρχει τι εννοείτε με τον όρο μέγεθος σκάλας και πώς να το χρησιμοποιήσετε;, αυτή τη φορά γύρω από το know.co.id θα συζήτησε το...
- Ομοιοπολικοί δεσμοί: Ορισμός, Χαρακτηριστικά, Τύποι, Τύποι… Ομοιοπολικοί δεσμοί: Ορισμός, χαρακτηριστικά, τύποι, χημικοί τύποι και ιδιότητες ενώσεων - Τι είναι ο ομοιοπολικός δεσμός; Με αυτή την ευκαιρία, το Seputarknowledge.co.id θα το συζητήσει και φυσικά και για άλλα πράγματα το κάλυψε. Αφήνω…
- Περιβαλλοντική Ομιλία: Ορισμός, Σκοπός, Χαρακτηριστικά και… Περιβαλλοντικός Λόγος: Ορισμός, Σκοπός, Χαρακτηριστικά και Παραδείγματα - Πώς είναι δομημένο το κείμενο του περιβαλλοντικού λόγου; τι είναι καλό και σωστό; Με αυτήν την ευκαιρία, το Seputarknowledge.co.id θα το συζητήσει και φυσικά τα πράγματα Οι οποίες…
- Τύποι κώνων, χαρακτηριστικά, ιδιότητες, στοιχεία και παραδείγματα προβλημάτων Τύποι κώνου, χαρακτηριστικά, ιδιότητες, στοιχεία και παραδείγματα Πρόβλημα - Πώς να υπολογίσετε το εμβαδόν και τον όγκο ενός σχήματος cone space;, Με αυτήν την ευκαιρία, το Seputarknowledge.co.id θα το συζητήσει και φυσικά για άλλα πράγματα Οι οποίες…
- Τύπος ιξώδους: Ορισμός ιξώδους, συντελεστής και… Τύπος ιξώδους: Ορισμός ιξώδους, συντελεστής και παράγοντες που επηρεάζουν - Πώς είναι ο τύπος ιξώδους Το ιξώδες είναι μια μέτρηση της αντίστασης ενός ρευστού που μεταβάλλεται είτε από την τάση είτε από πίεση. Με αυτή την ευκαιρία, το Seputarknowledge.co.id…
- Μονάδα βάρους: Ορισμός, Κλίμακα μετατροπής και Παραδείγματα… Μονάδα βάρους: Ορισμός, Κλίμακα μετατροπής και Παράδειγμα Προβλήματος - Τι είναι μια Μονάδα Βάρους;, Σε αυτήν την περίπτωση Σχετικά με το know.co.id θα το συζητήσει, συμπεριλαμβανομένης της κατανόησης και φυσικά και άλλων πραγμάτων το κάλυψε. Αφήνω…
- Ροπή Αδράνειας: Ορισμός, Παράγοντες, Εξισώσεις Μορφών… Ροπή Αδράνειας: Ορισμός, Παράγοντες, Εξισώσεις σε Μορφές Αντικειμένων και Παραδείγματα Προβλημάτων - Τι σημαίνει με τη Στιγμή της Αδράνειας;, Με την ευκαιρία αυτή, ο Se σχετικά με το know.co.id θα το συζητήσει και φυσικά για ύλη…
- Ομοιόμορφα μεταβαλλόμενη κυκλική κίνηση: Ορισμός, Μέγεθος… Ομοιόμορφα μεταβαλλόμενη κυκλική κίνηση: ορισμός, φυσική ποσότητα, τύποι και παραδείγματα προβλημάτων - Τι είναι η κίνηση Κυκλικές αλλαγές τακτικά και παραδείγματα; Με αυτήν την ευκαιρία, το Seputarknowledge.co.id θα το συζητήσει και φυσικά για...
- Αόριστο ολοκλήρωμα: Ορισμός, τύποι, ιδιότητες και παραδείγματα… Αόριστο ολοκλήρωμα: Ορισμός, τύποι, ιδιότητες και παραδείγματα προβλημάτων - Τι σημαίνει αόριστο ολοκλήρωμα Φυσικά και πώς υπολογίζονται οι μαθηματικές πράξεις; θα…
- Ορισμός Μαθησιακών Μεθόδων: Χαρακτηριστικά, Σκοπός, Τύποι και… Ορισμός Μαθησιακών Μεθόδων: Χαρακτηριστικά, Σκοπός, Τύποι και Συζήτηση - Τι σημαίνει Μέθοδος Learning?, Με αυτή την ευκαιρία, το Seputarknowledge.co.id θα το συζητήσει και φυσικά για άλλα πράγματα Επίσης…
- Χημική Ισορροπία: Ορισμός, Νόμοι, Τύποι, Παραδείγματα Προβλημάτων Χημική Ισορροπία: Ορισμός, Νόμοι, Τύποι, Παραδείγματα Προβλημάτων - Σε αυτή τη συζήτηση θα εξηγήσουμε σχετικά με τη χημική ισορροπία, τον νόμο του τύπου και εξοπλισμένο με παραδείγματα χημικής ισορροπίας με πλήρη και...
- Λύσεις οξέος-βάσης: Ορισμός, Θεωρία Οξέος-Βάσεων, Ιδιότητες και… Λύσεις οξέος-βάσης: Ορισμός, Θεωρία οξέος-βάσης, ιδιότητες και τύποι - Τα διαλύματα οξέος και βάσης είναι δύο ομάδες χημικών ενώσεων που βρίσκονται και χρησιμοποιούνται ευρέως στην καθημερινή ζωή.
- Δημιουργία χώρου – Ορισμός, τύποι και διάφορα… Δόμηση χώρου – Ορισμός, τύποι και οι διάφοροι τύποι του - Με αυτήν την ευκαιρία, θα θέλαμε να αναθεωρήσουμε το μαθηματικό υλικό σχετικά με τα γεωμετρικά σχήματα, τόσο από την άποψη της κατανόησης όσο και από άλλα. Ας συζητήσουμε αμέσως...
- √ Δείκτης οξέος-βάσης: Ορισμός, τύποι και παραδείγματα Δείκτες οξέος-βάσης: Ορισμός, τύποι και παραδείγματα - Με αυτήν την ευκαιρία, το Around Knowledge θα συζητήσει τους δείκτες οξέος-βάσης. Το οποίο σε αυτή τη συζήτηση εξηγεί την έννοια του δείκτη οξέος...
- Νόμος του Boyle: Ορισμός, τύποι, εφαρμογές και παραδείγματα… Νόμος του Boyle: Ορισμός, Τύποι, Εφαρμογές και Παραδείγματα Προβλημάτων - Σε αυτή τη συζήτηση θα εξηγήσουμε για το νόμο του Boyle. Το οποίο περιλαμβάνει την έννοια του νόμου του Boyle, τον τύπο του νόμου του Boyle, την εφαρμογή του…
- Παρακινητικά διηγήματα: ορισμός, συμβουλές γραφής και παραδείγματα Υποκινούμενα διηγήματα: Ορισμός, Συμβουλές γραφής και Παραδείγματα - Τι είναι μια Παρακινητική Μικρή ιστορία;, On Με αυτήν την ευκαιρία, το Seputarknowledge.co.id θα συζητήσει αν είναι η Μικρή Ιστορία της Φιλίας και άλλα πράγματα σχετικά με αυτό. Ας δούμε…
- Ορισμός της πίεσης: Τύποι πίεσης, τύποι και παραδείγματα προβλημάτων Ορισμός της πίεσης: Τύποι πίεσης, τύποι και παραδείγματα προβλημάτων - Τι είναι η πίεση; Με αυτή την ευκαιρία, γύρω από το know.co.id, θα συζητήσουμε τι είναι πίεση και ποια άλλα στοιχεία το κάλυψε. Ας δούμε…
- Δυναμικά Ρευστά: Τύποι, Χαρακτηριστικά, Εξίσωση Bernoulli, Θεωρήματα… Δυναμικά ρευστά: τύποι, ιδιότητες, εξίσωση Bernoulli, θεώρημα Toricelli, τύποι και παραδείγματα προβλημάτων - Τι είναι δυναμικά υγρά και τα είδη τους; σχετικά με…
- Πυκνότητα νερού: Ορισμός, τύποι και παραδείγματα Πυκνότητα νερού: Ορισμός, τύποι και παραδείγματα - Ποια είναι η πυκνότητα του νερού; Ας δούμε μαζί…
- Ορισμός Ποσότητας, Μονάδας, Μέτρησης και Παραδείγματα… Ορισμός Ποσότητας, Μονάδας, Μέτρησης και Παραδείγματα (Πλήρη) - Στις βασικές έννοιες της φυσικής, σίγουρα έχουμε μυηθεί σε κάτι που σχετίζεται με την καθημερινή ζωή. Όπως η μέτρηση ύψους, ζύγισης μάζας, μέτρησης πλάτους,...
- Παραδείγματα Επιστημονικής Εργασίας: Λειτουργίες και Κανόνες Γλώσσας Παραδείγματα Επιστημονικών Εργασιών: Λειτουργίες και Κανόνες Γλώσσας - Ποια είναι παραδείγματα καλών και σωστών μορφών συγγραφής επιστημονικών εργασιών; Προηγουμένως, το Seputar the Knowledge.co.id είχε συζητήσει Επιστημονική Εργασία: Ορισμός, Χαρακτηριστικά, Οφέλη,…
- Παραδείγματα επίπεδων σχημάτων: Τύποι, χαρακτηριστικά και τύποι επίπεδων σχημάτων Παραδείγματα Επίπεδων Σχημάτων: Τύποι, Ιδιότητες και Τύποι Επίπεδων Σχημάτων - Ποια είναι τα παραδείγματα Επίπεδων Σχημάτων;
- Δείγμα Ερωτήσεων Φυσικής Αγωγής για Τάξη 11 (XI) SMA/MA/SMK Εξάμηνο 1 και 2 Παραδείγματα Ερωτήσεων Φυσικής Αγωγής για την Τάξη 11 (XI) για SMA/MA/SMK Εξάμηνο 1 και 2 (2019 και 2020) - Με αυτήν την ευκαιρία, το Seputarknowledge.co.id θα συζητήσει παραδείγματα Ερωτήσεων Φυσικής Αγωγής για την Τάξη 11 Πολλαπλής Επιλογής και Δοκίμιο ...
- Η βροχόπτωση είναι: 12 ορισμοί σύμφωνα με τους ειδικούς, είδη,… Η βροχόπτωση είναι: 12 ορισμοί σύμφωνα με τους ειδικούς τύπους και παράγοντες - Σε αυτή τη συζήτηση, το Around Knowledge θα εξηγήσει σχετικά με τη βροχόπτωση. Οι βροχοπτώσεις είναι ένα κλιματικό γεγονός που είναι φυσικό,...
- √ Ορισμός χημικών ενώσεων, χαρακτηριστικών, τύπων και ονοματολογίας… Ορισμός Χημικών Ενώσεων, Χαρακτηριστικά, Τύποι, Πλήρης Ονοματολογία - Σε αυτή τη συζήτηση θα εξηγήσουμε για τις Χημικές Ενώσεις. Καλύπτει τον ορισμό, τα χαρακτηριστικά, τους τύπους και την ονοματολογία των χημικών ενώσεων με συζήτηση...
- Οι μεμονωμένες ουσίες είναι: Ορισμός, στοιχεία και ενώσεις Οι μεμονωμένες ουσίες είναι: Ορισμοί, στοιχεία και ενώσεις - Τι σημαίνει μια μεμονωμένη ουσία; Ας δούμε μαζί τη συζήτηση...
- Κεκλιμένο επίπεδο: Ορισμός, τύποι, μηχανικό πλεονέκτημα και… Λοξό επίπεδο: Ορισμός, τύποι, μηχανικά πλεονεκτήματα και παραδείγματα προβλημάτων - Τι σημαίνει επίπεδο πλάγια και πώς να υπολογίσω τη φυσική; Φυσικά…
- Μετατροπή μονάδας: Ορισμός, Συντελεστής, Μήκος, Μάζα, Χρόνος,… Μετατροπή μονάδας: Ορισμός, συντελεστής, μήκος, μάζα, χρόνος, όγκος και πίεση - Τι είναι η μετατροπή μονάδας;, Με αυτήν την ευκαιρία, το Seputarknowledge.co.id θα το συζητήσει, συμπεριλαμβανομένων παραγόντων, τύπων και φυσικά άλλων πραγμάτων Οι οποίες…
