Redox-Reaktionsmaterial: Konzepte, Ausgleiche, Beispiele
Wird geladen...
Beispiele für Redoxreaktionen, die wir oft hören, wenn wir in der High School waren. Eine Redoxreaktion ist eine chemische Reaktion, die aufgrund einer Kombination von Reduktions- und Oxidationsreaktionen auftritt. Deshalb wird der Begriff zu Redox (Reduktion-Oxidation)
Diese Reaktion umfasst alle chemischen Prozesse von Atomen bis hin zu Zustandsänderungen der Oxidationszahl oder Oxidationsstufe. Bei einer vollständigen chemischen Reaktion folgt auf diese Oxidationsreaktion immer eine Reduktionsreaktion, daher spricht man von einer Redoxreaktion.
Inhaltsverzeichnis
Reduktion und Oxidation

Wie bereits erwähnt, sind Redoxreaktionen eine Abkürzung für Reduktions- und Oxidationsreaktionen, die auftreten, wenn ein elektrochemischer Prozess abläuft.
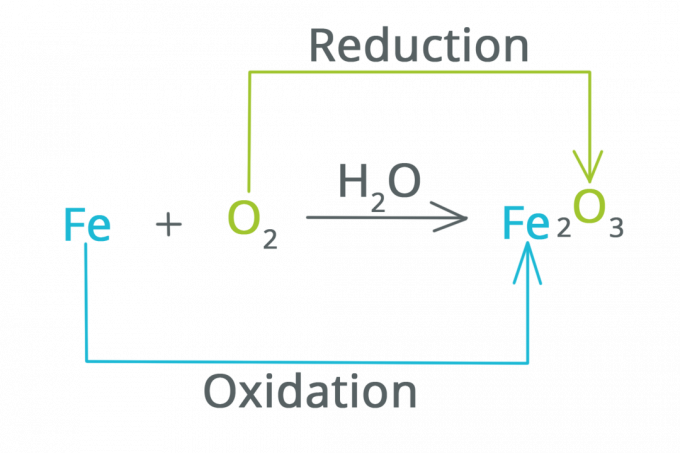
Reduktion ist eine Reaktion, bei der die Oxidationszahl abnimmt und Elektronen zunehmen. Man kann sagen, dass Reduktion eine Reaktion ist, die dazu führt, dass eine Substanz Sauerstoff verliert.
Oxidation ist eine Reaktion, bei der die Oxidationszahl zunimmt und Elektronen abnehmen. Man kann sagen, dass Oxidation eine Reaktion ist, bei der eine Substanz an Sauerstoff bindet.
Lesen: Flüssigkeit
Oxidationszahl (Oilox)

Das Konzept einer Redoxreaktion mit Elektronenübertragung kann nur bei ionischen Verbindungen auftreten, bei kovalenten Verbindungen jedoch nicht. Daher entstand ein drittes Redoxkonzept, nämlich basierend auf Änderungen der Oxidationszahlen.
Die Oxidationszahl ist die positive und negative Ladung eines Atoms. Elemente mit positiven Oxidationsstufen sind im Allgemeinen Atome mit metallischen Elementen, während für Elemente mit negativen Oxidationsstufen im Allgemeinen Nichtmetallatome verwendet werden.
Basierend auf dem Konzept der Änderung der Oxidationszahl gibt es acht Regeln zur Bestimmung dieser Zahl, nämlich:
- Die Oxidationszahl freier Elemente mit Atom- und Molekülform ist 0
- Die Oxidationszahl von einatomigen und mehratomigen Ionen entsprechend der Ladungsart des Ions
- Die Oxidationszahl der Elemente in den Gruppen IA, IIA, IIIA entsprechend der Gruppe, zu der sie gehören
- Die Oxidationszahl der Nebengruppenelemente ist größer als eins
- Die Summe der Oxidationszahlen der Elemente, aus denen ein Ion besteht = die Ladungsmenge, die es hat
- Die Oxidationszahl von Wasserstoff bei Bindung an ein Metall = -1, bei Bindung von H an ein Nichtmetall dagegen +1
- Sauerstoffzahl in Peroxidverbindungen = -1, Oxidationszahl von O in Nicht-Peroxidverbindungen = -2
Reduzieren und Oxidieren

Bevor auf Beispiele von Redoxreaktionen eingegangen wird, schadet es nie, zuerst die Reduktionsmittel und Oxidationsmittel zu kennen. Bei einer Reaktion, die eine Oxidationsreaktion und eine Reduktion beinhaltet, begleitet von einer Änderung der Oxidationszahl.
Oxidationsmittel sind Stoffe, die andere Stoffe oxidieren können oder Stoffe, die bei ihrer Reaktion reduziert werden. Während das Reduktionsmittel eine Substanz ist, die andere Substanzen reduzieren kann oder Substanzen, die einer Oxidation unterliegen, wenn sie reagieren.
Lesen: Fest
Eigenschaften der Redoxreaktion
Neben Beispielen für Redoxreaktionen sollten wir auch die Eigenschaften dieser Reaktion kennen, unter anderem die folgenden Eigenschaften:
- Es gibt Reduktionsmittel und Oxidationsmittel
- Es findet eine Änderung des Oxidationszustandes statt
- Es gibt freie Elemente wie Chlor, Sauerstoff, Cuprum und andere.
Redoxreaktionsfunktion

Es gibt verschiedene Funktionen von Redoxreaktionen im Alltag, nämlich:
- Um den Prozess der Metallkorrosion zu verstehen und wie man sie verhindert
- Anwendung von Belebtschlamm als Abwasserbehandlung
- Prozess der pflanzlichen Photosynthese
- Die Oxidation von Nahrung in Zellen sehen
- Schrauben und Muttern erhalten einen Zinküberzug, in dieser Schicht findet ein Zinkoxidationsprozess und eine Kationenreduktion statt
- Küchenutensilien aus Edelstahl herstellen, damit sie nicht rosten
- Herstellung von Schwefelsäure und Verarbeitung von Erz für den industriellen Bedarf.
Redox-Reaktionsausgleich

Tatsächlich findet diese Redoxreaktion in wässrigen Lösungsmitteln statt, also beinhaltet die Gleichung, die er hat, H+- und OH--Ionen. Es gibt 2 Methoden, um es zu lehren, nämlich durch Oxidationszahlen und Halbreaktionen.
Das Ausgleichen von Redoxreaktionen kann durch Ausgleichen der Oxidationszahlen oder Oxidationsstufen erfolgen, sowohl bei molekularen als auch bei ionischen Reaktionen. Diese Oxidationsmethode basiert auf „Die Summe aller e-oxidierten ist gleich der Gesamtmenge an e-reduzierten“.
Beispiele für Redoxreaktionen im täglichen Leben

In Beispielen zu Redoxreaktionsproblemen finden wir oft Fragen, um Redoxreaktionen im Alltag zu erwähnen. Beispiele für Redoxreaktionen im Alltag sind:
1. Kleidung bleichen
Bleichmittel ist eine Verbindung, die Farbe von Objekten entfernen kann. Zum Beispiel Textilien. Der durch Bleichmittel verursachte Farbverlust ist auf eine Oxidationsreaktion zurückzuführen.
Oxidationsmittel, die häufig in Bleichmitteln verwendet werden, sind Wasserstoffperoxid und Natriumhypochlorit.
2. Prozess der pflanzlichen Photosynthese
Die Photosynthese ist ein natürlicher biologischer Oxidations-Reduktions-Reaktionsprozess. Die Photosynthese selbst ist ein sehr komplexer Prozess.
Organismen aus dem Photosyntheseprozess können die Energie des Sonnenlichts nutzen, um durch Redoxreaktionen Zucker und Sauerstoff zu produzieren.
3. Propangasverbrennung
Ein weiteres Beispiel ist die Verbrennung. Bei der Propangasverbrennung enthält die Luft O2, während die Kohlenstoffatome oxidiert werden und CO2 bilden, während Sauerstoff zu H2O wird.
Lesen: Gas-Substanz
Beispiele für Redoxreaktionsprobleme

Anzeige
1. Bestimmen Sie die Oxidationsstufe des Elements in der Verbindung SO42- und NaNO3
Antworten:
ALSO42– = mehratomiges Ion
Oxx eines mehratomigen Ions = Gesamtladung = -2
Oxox von O in der Verbindung = -2
Der Block S + 4. Oxidationszustand = -2
-6 + 4. (-2) = -2
Also ist die Oxidationszahl von S = -6 und die Oxidationszahl von O = -2.
NaNO3 = Verbindung ohne Gebühr
Gesamtoxidationszustand = 0
Oxox von O in der Verbindung = -2
Oxx von Na (Metall) = Zahl der Valenzelektronen = +1
Die Oxidationsstufe ist Na + die Oxidationszahl ist N + 3. Oxidationsstufe = 0
+1 + (+5) + 3. (-2) = 0
Also ist der Oxidationszustand von Na = +1, der Oxidationszustand von N = +5 und der Oxidationszustand von O = -2
2. Welches der folgenden ist das Oxidationsmittel, das Reduktionsmittel, das Reduktionsmittel und das Produkt der folgenden chemischen Reaktion?
Fe + HCl → FeCl3 +H2
Antworten:
Oxidationsmittel (reduziert) = HCl
Reduktionsmittel (oxidierend) = Fe
Oxidationsprodukt = FeCl3
Reduktionsergebnis = H2
3. Gleichen Sie die folgenden Redoxgleichungen aus
Bi2Ö3 + CIO– → 2BiO3– +Kl– (Sprachatmosphäre).
Antworten:
Wie man die Oxidationszahl
Angeglichene linke und rechte Ladung: 2OH– +Bi2Ö3 + CIO– → 2BiO3– +Kl–
Die gleiche Anzahl von Atomen: 2OH– +Bi2Ö3 + 2ClO– → 2BiO3– + 2Cl– +H2Ö
Also äquivalente Reaktion: 2OH– +Bi2Ö3 + 2ClO– → 2BiO3– + 2Cl– +H2Ö
Halber Reaktionsweg
Redox: Bi2Ö3 + 2ClO– → 2BiO3– + 2Cl–
Gleichen Sie die Ladung durch Hinzufügen von OH aus– (Base).
2OH– +Bi2Ö3 + 2ClO– → 2BiO3– + 2Cl–
Gleichen Sie die Anzahl der Atome aus, indem Sie H hinzufügen2Ö.
2OH– +Bi2Ö3 + 2ClO– → 2BiO3– + 2Cl– +H2Ö
Also äquivalente Reaktion: 2OH– +Bi2Ö3 + 2ClO– → 2BiO3– + 2Cl– +H2Ö
Das Studium von Beispielen für Redoxreaktionen und sogar ihre vollständige Diskussion ist nicht einfach, außerdem gibt es so viele Verbindungen, die in diesem Material auswendig gelernt werden müssen. Zögern Sie daher nicht, weiter zu üben, um es gut zu verstehen.
ANZEIGE
X SCHLIESSEN
