Material zum Gesetz von Faraday: Laute, Formeln, Beispielaufgaben
Wird geladen...
Weißt du, was das Faradaysche Gesetz ist? Eines der Gesetze im Zusammenhang mit Elektromagnetismus und Vorhersagen über Wechselwirkungen zwischen elektrischen Schaltkreisen und Magnetfeldern, so dass sie elektromotorische Kräfte erzeugen können.
1833 vom britischen Wissenschaftler Michael Faraday entdeckt, wird es bis heute immer noch verwendet und ist in bestimmten Bereichen sehr nützlich. Sie möchten wissen, was es bedeutet und ein Beispiel für die Frage?
Inhaltsverzeichnis
Faradays 1. Gesetz

Es gibt zwei Faradaysche Gesetze, das erste bezieht sich auf den Prozess der Elektrolyse und der elektrischen Ladung.
Es lautet: "Die Masse der Substanz, die während des Elektrolyseprozesses von einer Elektrode erzeugt wird, ist direkt proportional zur Menge der verwendeten elektrischen Ladung."
Die verwendeten Gleichungen sind:
WQ
W = Masse eines Stoffes
Q = elektrische Ladung von Elektronen
Die Verwendungen sind:
Q = ich x t
i = elektrischer Strom (in Ampere)
t = Zeit (in Sekunden)
Mit der Erklärung, dass die Summe der Verwendung elektrischer Ladungen das Ergebnis gleich dem Produkt der Stromstärke mit der Zeit ist.
Darüber hinaus gibt es weitere Ähnlichkeiten aus den Ergebnissen der Anwendung des oben genannten Gesetzes, die zu Folgendem werden:
w ich x ta
Die in seiner Anwendung verwendete Formel lautet:
W = e.i.t/F
Information:
W = Masse eines in einem Elektrolyseprozess hergestellten Stoffes (in Gramm)
e = äquivalente Masse
i = Stromstärke (in Ampere)
t = Zeit (in Sek.)
F = Faradaysche Bestimmung mit einer eindeutigen Zahl von 96.500 Coulomb/mol.
Die Anwendung des Faradayschen Gesetzes in der Welt der Chemie kann anhand mehrerer Komponenten im Zusammenhang mit elektrischem Strom und Elektrolyse gesehen werden.
Wie beim elektrischen Generator, der ein spezielles Gerät mit der Funktion ist, elektrische Energie durch mechanische Quellen zu erzeugen und elektromagnetische Induktion zu nutzen. Generatoren haben zwei Arten, nämlich der Strom fließt hin und her und direkt.
Die nächste Anwendung ist ein Dynamo, der zwei Arten hat, nämlich Wechselstrom und Gleichstrom.
Lesen: Kirchhoffsches Gesetz
Faradays 2. Gesetz

Im Gegensatz zu Faradays 1. Gesetz gibt es noch ein zweites mit dem Laut „Die Masse der Substanz, die von produziert wird eine Elektrode während des Elektrolyseprozesses, ist direkt proportional zur äquivalenten Masse der Substanz das.
Während das, was mit der Masse eines Stoffes gemeint ist, die Masse eines Stoffes ist, ist in einer Anwendung das Gesetz. Dann ist die äquivalente Masse die Masse einer Substanz, die stöchiometrisch die gleiche Anzahl von Molen hat wie 1 Mol eines Elektrons.
Die Gleichung lautet:
Masse des Stoffes Massenäquivalent des Stoffes
w ICH
ME = Oxidationsstufe oder Ladung des Ions/Ar
Die bei der Anwendung dieses zweiten Hauptsatzes verwendete Formel lautet:
W1/W2 = e1/e2
Information:
W1 = Masse der ersten Substanz (in Gramm)
W2 = Masse des zweiten Stoffes (in Gramm)
e1 = äquivalente Masse des ersten Stoffes
e2 = äquivalente Masse des zweiten Stoffes
Bei der Anwendung dieses zweiten Hauptsatzes ist die äquivalente Massenfunktion sehr wichtig. Geteilt durch die Änderung der Oxidationszahl, die bei einer Elektrolysereaktion auftritt.
Die Gleichung lautet:
MEiche = Ar
Änderung der Oxidationszahl
Wenn man sich auf grundlegende stöchiometrische Konzepte bezieht, gibt es eine Beziehung zwischen der Masse, der Anzahl der Mo und der Masse des Molaren, die eng mit der kombinierten Anwendung des 1. und 2. Faradayschen Gesetzes zusammenhängt.
Die Gleichung lautet:
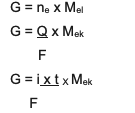
Die Zusammenfassung ist die kombinierte Gleichung zwischen und 2, nämlich:
Anzeige
G ~ ich x t x MEiche
Information:
G = Masse des Produkts (in Gramm)
Q = elektrische Ladung (in Coulomb-Einheiten)
i = Stromstärke (in Ampere)
t = Zeit (in Sek.)
MEiche= Äquivalentmasse des Stoffes (in Gramm/Mol)
F = Faraday-Konstante, die 96.500 Coulomb/Mol beträgt)
Lesen: Hookes Gesetz
Beispiel für das Problem des Faradayschen Gesetzes
Um die Anwendung des Faradayschen Gesetzes besser zu verstehen, sind hier einige Anwendungsbeispiele aufgeführt.
1. Beispiel 1
In einem Stromkreis hat es eine Cu-Ablagerung in der Größenordnung von 5 Gramm gegeben. Welche Masse an Ag hat sich an den Elektroden niedergeschlagen? Für zusätzliche Informationen Ag = 108 und Cu = 63,5.
Für die Formel, um die Masse von Ag oder W zu findenAg Sie können die folgende Formel verwenden:
WCu = ICHCu
WAg= ICHAg
ME ist durch die Gleichung = bekannt EINr
Oxidationszahl = 2
Ist bekannt:
WCu = 5 Gramm
Berechnen Sie zuerst den ME der beiden Substanzen, indem Sie die Reduktionsreaktionen von Cu und Ag wie folgt verwenden:
Cu2+ + 2e– → Cu(s), MEcu
= Ar = 63,5
Oxidationszahl =2
= 31,75
Ag+ + z– → Ag(s) ICHAg
= Ar = 108
Oxidationszahl = 1
= 108
nächsten 5gCu = 31.75
WAg 108
= 17
Die sich absetzende Ag-Masse beträgt also = 17 Gramm.
2. Beispiel 2
Wie viele Faradays werden benötigt, um Ca.-Ionen zu reduzieren?2+ mit der Menge von 12 Gramm? Hier ist die Diskussion:
Ca2+→ die Wertigkeit ist 2
Ar von Ca ist 40
Die verwendete Formel lautet W = e x F
Wo finde ich F = W/e
Die Antwort ist:
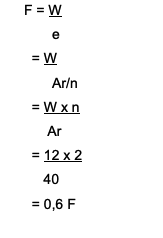
Es braucht also 0,6 Faraday, um Ca.-Ionen zu reduzieren2+ was 12 Gramm entspricht.
Lesen: Coulomb-Gesetz
3. Beispiel 3
Ein elektrischer Strom von 0,2 Ampere wird für einen Zeitraum von 50 Minuten fließen gelassen und tritt dann in die Elektrolysezelle ein, die eine CuCl-Lösung enthält.2. Wie groß ist die Menge an Cu-Präzipitat, die sich an der Kathode bildet? Als Zusatzinformation Ar aus Cu = 63,5
Ist bekannt:
Strom mit Symbol I = 0,2 Ampere
Zeit mit dem Symbol t = 50 Minuten, wenn es als Sekunden verwendet wird, ist es 50 x 60 Sekunden, was 3.000 Sekunden entspricht
Gefragt: WCu?
Antwort: Schreiben Sie zuerst die Cu-Reduktionsreaktion auf, nämlich:
Cu2+ (aq) + 2e+ → Cu(s)
MICHCu = Ar
Oxidationszahl = 63,5/2
= 31,75
Die Formel, die verwendet wird, um W zu findencu ist:
Wcu = (1/96.500) x ich x t x MEcu
= (1/96.500) x 0,2 A x 3.000 s x 31,75
= 0,197 Gramm
Der Wert der auftretenden Cu-Abscheidung beträgt also 0,197 Gramm.
4. Beispiel 4
Bei einer Elektrolyse mit einer Elektrode vom Kohlenstofftyp war es möglich, einen Niederschlag vom Cu-Typ mit einer Menge von 12,7 Gramm zu erzeugen. Verwendet einen elektrischen Strom von 4 Ampere. Wie lange dauert die Elektrolyse?
Ist bekannt:
Ar von Cu = 63,5
Gefragt: W?
Antworten:

Die Zeit für die Elektrolyse beträgt also 9.650 Sekunden, wenn die Formel aus dem geltenden Faradayschen Gesetz verwendet wird.
Für diejenigen unter Ihnen, die Chemie studieren, benötigen Sie natürlich wirklich ein richtiges Verständnis des Faradayschen Gesetzes. Damit Sie eine Aufgabe im Zusammenhang mit der Rechtsanwendung anhand der bereits verfügbaren Formeln richtig und gründlich beantworten können.
X SCHLIESSEN
Anzeige
ANZEIGE
X SCHLIESSEN
