Stöchiometrie-Chemie: Konzepte, Typen, Beispielprobleme
Wird geladen...
Der Begriff der Stöchiometrie ist eine Wissenschaft in der Chemie, die die Grundlage für die Berechnung des quantitativen Verhältnisses von Reaktanten und Produkten bildet, die bei chemischen Reaktionen auftreten. Sie basiert auf der Reaktionsgleichung und den Grundgesetzen.
Das Kennzeichen stöchiometrischer Reaktionen ist, dass es keine Rückstände von den Reaktanten oder Reaktionen gibt, weil sie alle aufgebraucht sind. Im Allgemeinen wurde dieses Material in der 10. Klasse der High School unterrichtet und kommt oft in verschiedenen Schulprüfungen heraus. Hier ist eine vollständige Erklärung.
Inhaltsverzeichnis
Stöchiometrische Chemie Materi
Stöchiometrie zu studieren bedeutet, mehrere zusammenhängende Dinge zu verstehen. Einige dieser Dinge umfassen die Grundgesetze der Chemie, verwandte Konzepte in der Chemie und ihre Typen. Es werden auch Übungsfragen benötigt, damit das Verständnis, das sie haben, ausgereifter ist.
Grundgesetze der Chemie für die Stöchiometrie
Es gibt 5 Grundgesetze in der Chemie, die man kennen muss, um die Stöchiometrie zu verstehen, darunter:
1. Gesetz der Erhaltung der Masse

1789 formulierte ein Chemiker namens Lavoisier das Massenerhaltungsgesetz. Der Kern des Massenerhaltungssatzes besteht darin, dass das Gesamtgewicht einer Substanz sowohl vor als auch nach einer chemischen Reaktion gleich bleibt.
Beispielsweise ändert sich die Masse des Holzes vor der Verbrennung nicht mit der Masse des Verbrennungsergebnisses. Mit anderen Worten, die Masse einer Substanz oder eines Objekts, die vor und nach einer Reaktion vorhanden ist, bleibt erhalten.
2. Gesetz des festen Vergleichs

Joseph Proust war ein Experte, der 1799 das Gesetz der festen Proportionen schuf. Dieses Gesetz besagt, dass sich das Verhältnis des Gesamtgewichts der Elemente, aus denen eine bestimmte Verbindung besteht, nicht ändert oder konstant bleibt.
Zur Veranschaulichung ist das Verhältnis der in einer Lösung enthaltenen Massen von Stoff A und Stoff B immer konstant und wird durch das Volumen der Lösung überhaupt nicht beeinflusst.
3. Gesetz des multiplen Vergleichs

Darüber hinaus ist das Grundgesetz der Stöchiometrie, das verstanden werden muss, das Gesetz der multiplen Verhältnisse, das von John Dalton im Jahr 1803 aufgestellt wurde. Mehrfachvergleiche sind eine Erweiterung des Gesetzes des ständigen Vergleichs.
Das Gesetz der multiplen Proportionen besagt, dass wenn 2 Elemente mehr als 2 Verbindungen bilden, ihr Gesamtgewicht gleich ist eines der konstituierenden Elemente konstant ist, dann ist das Gesamtgewicht der anderen konstituierenden Elemente eine ganze Zahl einfach.
4. Gay Lussacs Gesetz
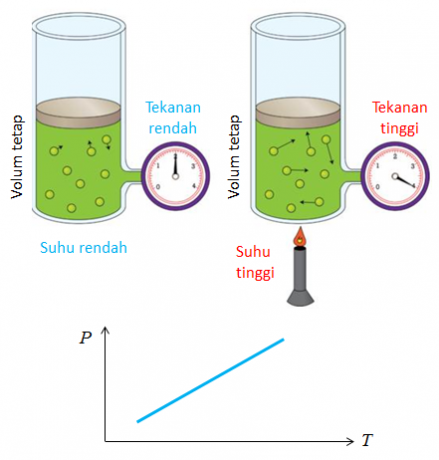
Ein anderer Name für das von Joseph Gay Lussac entdeckte Gesetz ist das Gesetz des Verhältnisses der Volumen. Die Schlussfolgerung aus dem Gesetz des Volumenvergleichs ist, dass Temperatur und Druck die Änderung des Gasvolumens beeinflussen.
5. Die Hypothese von Avogadro
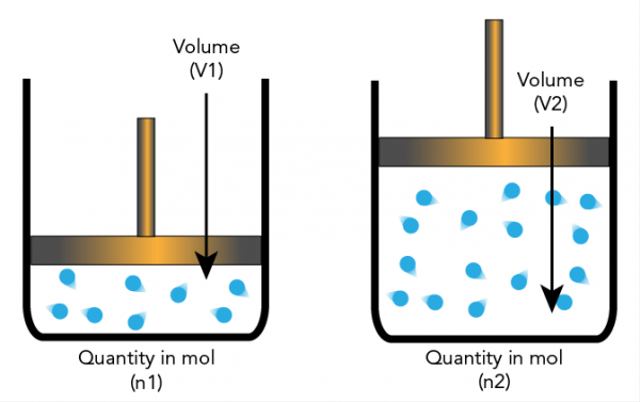
Amadeo Avogadro stellte eine Hypothese auf, dass Elementarteilchen Moleküle und Elemente sein können, so dass sie nicht immer Atome sind. Dies führt zu weiteren Erklärungen, auf denen die Stöchiometrie beruht.
Die Hypothese von Avogadro besagt, dass, wenn Temperatur und Druck die gleiche Zahl haben, das Verhältnis von Gasen mit demselben Volumen die gleiche Anzahl von Molekülen haben wird.
Lesen: Kolloidales Material
Chemische Konzepte zum Verständnis der Stöchiometrie
Nicht nur grundlegende Gesetze, sondern auch andere wichtige Dinge, die eng mit stöchiometrischem Material zusammenhängen, sind Konzepte in der Chemie. Zumindest müssen 4 Konzepte verstanden werden, nämlich die relative Atommasse, die relative Molekülmasse, die Molarität und das Konzept der Mole.
1. Relative Atommasse (Ar)
In der Chemie ist die Abkürzung für relative Atommasse Ar. Dieses Konzept bezieht sich auf das Gesamtatomgewicht, das durch Vergleich mit dem Standard-Atomgesamtgewicht bestimmt wird. Die International Union of Pure and Applied Chemistry verwendet das Kohlenstoffatom als Bestimmungsstandard.
Das Kohlenstoffatom oder das C-12-Isotop wurde gewählt, weil es einen stabilen Kern hat, der inerter ist als andere Atomarten. Inert bezieht sich auf die Beständigkeit gegenüber auftretenden chemischen Reaktionen.
2. Relative Molekülmasse (Mr)
Außerdem gibt es das Konzept der relativen Molekülmasse, abgekürzt als Mr. Das Konzept der Stöchiometrie Mr ist das Gesamtgewicht eines Moleküls, dessen Messung atomare Masseneinheiten verwendet.
Anzeige
Basierend auf diesem Konzept haben verschiedene Moleküle mit derselben Verbindung die Möglichkeit von Unterschieden in der Molekülmasse, da die darin enthaltenen Isotope von verschiedenen Elementen stammen.
3. Mol-Konzept
In der Chemie gibt es zur Vereinfachung des Rechenvorgangs eine Recheneinheit, nämlich das Mol. Das Molkonzept basiert auf der Avogadro-Zahl, um die Anzahl von Molekülen, Atomen oder Ionen darzustellen. Nach diesem Konzept entspricht 1 Mol 6,022 x 1023 die Teilchen der Substanz.
Man kann sagen, dass die Masse eines Mols Ar und Mr in Gramm entspricht. Beispielsweise ist das Gesamtgewicht der Molmasse von Kohlenstoff 12 g/mol gleich Ar von Kohlenstoff 12 amu.
4. Molarität
Molarität ist ein Konzept in der Chemie, das die Anzahl der Mole eines gelösten Stoffes angibt, die in 1 Liter Lösungsmittel vorhanden sind. Mit anderen Worten bezieht sich die Molarität auf die Konzentration, die die Menge an gelöstem Stoff pro Volumeneinheit besitzt.
Lesen: Molaritätsformel
Arten der chemischen Stöchiometrie

Bitte beachten Sie, dass es 3 Arten von Stöchiometrie gibt, nämlich Reaktionen, Gase und Verbindungen oder Zusammensetzungen. Hier ist eine vollständige Erklärung:
1. Reaktionsstöchiometrie
Die Definition der Reaktionsstöchiometrie ist eine Art Konzept, das die quantitative Beziehung zwischen Substanzen betont, die in einer bestimmten chemischen Reaktion vorhanden sind. Dieses Konzept wird verwendet, um die auftretenden chemischen Gleichungen auszugleichen.
Basierend auf dieser Erklärung kann gesagt werden, dass die Substanzen, die an einer chemischen Reaktion teilnehmen, das quantitative Verhältnis zwischen diesen Substanzen beeinflussen.
2. Gas-Stöchiometrie
Als nächstes bezieht sich die Gasstöchiometrie auf das Konzept chemischer Reaktionen, bei denen Gase vorhanden sind. Ein Gas mit einem bestimmten Druck, einer bestimmten Temperatur und einem bestimmten Volumen wird als ideales Gas angesehen. Das Gas besteht nur aus einer Gruppe von Teilchen, deren Bewegung zufällig ist und nicht wechselwirkt.
Die ideale Gasgleichung wird durch P.V = n ausgedrückt. R.T. In der Formel ist P der Druck in atm, V das Volumen des Gases in Litern, n die Anzahl der Mole, T die Temperatur von 273 K und R das Gas 0,082 L atm/mol K.
3. Zusammengesetzte Stöchiometrie
Die Definition der Stöchiometrie einer Verbindung oder Zusammensetzung ist ein Konzept, das das quantitative Verhältnis des Gesamtgewichts oder der Stoffmenge ausdrückt, die die Elemente in einer bestimmten Verbindung haben.
Dieses Konzept wird häufig verwendet, um das Gesamtgewicht von Wasserstoff und Stickstoff zu erklären, die sich zu komplexem Ammoniak verbunden haben.
Lesen: Dichte Formel
Beispiele für Stöchiometrie-Probleme und Diskussion

Wie man Probleme im Zusammenhang mit Stöchiometrie löst. Das Folgende ist ein Beispiel für eine Frage und ihre Diskussion, um sie leichter verständlich zu machen:
1. Finde die Anzahl jedes Atoms, das in 2 Mol H enthalten ist2Ö!
Zu beachten ist, dass H2O hat 2 H-Atome und 1 O-Atome. Dann wird die Lösung:
Die Zahl der H-Atome = 2 2 mol 6,02. 1023 Atome/Mol = 24,08. 1023 Atom. Die Anzahl der Atome, die in 2 Mol H enthalten sind, beträgt also 24,08. 1023.
Zählen Sie jetzt einfach die Anzahl der Atome, die das O-Atom besitzt, nämlich:
Die Anzahl der O-Atome = 1 2 mol 6,02. 1023 Atome/Mol = 12,04. 1023 Atom. Basierend auf diesen Berechnungen ist ersichtlich, dass die Anzahl der Atome in 2 Mol O 12,04 beträgt. 1023.
2. Berechnen Sie das Gesamtgewicht oder die Masse, die 2 Mol C besitzen6H12Ö6 (Glucose)! Es ist auch bekannt, dass die Summe von Ar C = 12, O = 16 und H = 1 ist.
Die Lösung:
Aus der Frage können die folgenden Informationen entnommen werden:
n = 2 mol
Herr C6H12Ö6 = (6 Ar C) + (12 1) + (6 16)
= 180
Als nächstes wird die Berechnung:
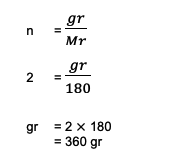
Also das Gesamtgewicht von 2 Mol Glucose oder C6H12Ö6 so viel wie 360 Gramm basierend auf diesen Berechnungen.
Eines der wichtigen Themen in der Chemie ist die Stöchiometrie, das Grundkonzept der Berechnung, um die quantitative Beziehung zwischen chemischen Gleichungen und Formeln herauszufinden. Einige andere Konzepte in der Chemie müssen ebenfalls verstanden werden, da sie mit der Stöchiometrie verwandt sind.
X SCHLIESSEN
Anzeige
ANZEIGE
X SCHLIESSEN
