Quantenzahlenmaterial: Typen, Beispielaufgaben (Zusammenfassung)
Wird geladen...
Einfach erklärt ist die Quantenzahl eine Zahl, die die Position von Elektronen und Energieniveaus beschreibt bzw der Abstand vom Atomkern auf einmal, die Form der Orbitale, die Orientierung der Orbitale und der Spin der im mechanischen Atommodell enthaltenen Elektronen Quantum.
Jedes Atom hat ein Orbital, und Atomorbitale haben unterschiedliche Energieniveaus. Das Energieniveau desselben Orbitals hat ein anderes Energieniveau, wenn die Atome unterschiedlich sind, sodass sich das 1s-Orbital für Wasserstoff im Energieniveau vom 1s-Orbital für Helium unterscheidet.
Inhaltsverzeichnis
Definition von Quantenzahlen

In der Wellenfunktion hat diese Zahl eine besondere Bedeutung, um den Zustand der Quantensituation zu beschreiben. Diese Zahlen können den Zustand der Elektronen im Atom beschreiben. 1926 stellte Erwin Schrödinger die Theorie der Quantenmechanik vor.
Diese Theorie erklärt die Struktur des Atoms. Dieses quantenmechanische Atommodell wird in einer mathematischen Gleichung ausgedrückt, nämlich der Wellengleichung. Das Lösen der Gleichung für das Wasserstoffatom ergibt eine Wellenfunktion oder ein Atomorbital.
Dieses Atomorbital soll die Lage der Quantenzahl der Elektronen im Atom beschreiben. Das Quadrat der Wellenfunktion bedeutet, dass es eine hohe Wahrscheinlichkeit gibt, ein Elektron in einem bestimmten Raumvolumen um den Atomkern herum zu bekommen.
Wie bei der Heisenbergschen Unschärferelation kann die Position von Elektronen in Atomen nicht bestimmt werden. Man kann nur wissen, wo sich das Elektron am ehesten aufhält.
Arten von Quantenzahlen
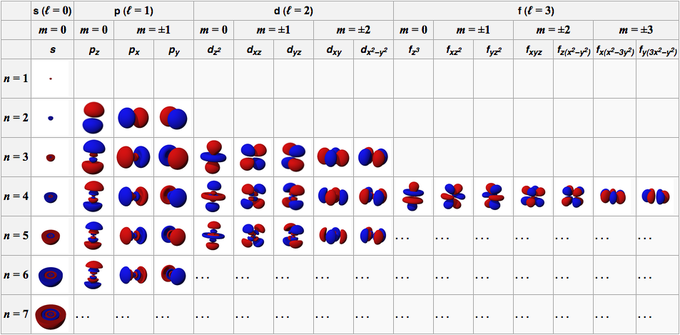
Das Orbital eines Atoms wird aus den Wellenfunktionen gebildet, aus denen das Orbital besteht. Unter allgemeinen Bedingungen werden die Bahneigenschaften eines Atoms durch vier Zahlen beschrieben, nämlich n, l, m und s.
1. Hauptquantenzahl (n)
Diese Zahl besteht aus positiven ganzen Zahlen, beginnend bei 1 (eins), wodurch der Wert von n 1, 2, 3, 4, 5 usw. ist. Diese Zahl bezieht sich auf die Hülle, die von einem Orbital in einem Atom besetzt ist.
2. Azimut-Quantenzahl (l)
Diese Zahl besteht aus positiven ganzen Zahlen, die bei 0 (Null) beginnen und den Wert von l zu 0, 1, 2, 3, 4, 5 usw. machen. Diese Nummern haben ein eigenes Zeichen; 0 ist das s-Orbital, 1 ist das p-Orbital, 2 ist das d-Orbital und 3 ist das f-Orbital.
3. Magnetische Quantenzahl (m)
Diese Zahl besteht aus ganzen Zahlen von 0 (Null) bis +/- 1, daher ist der Zahlenwert für jedes Orbital nicht gleich. Für das s-Orbital ist m 0, weil es sich im s-Orbital befindet, dann ist l 0. Für d-Orbitale, bei denen l 2 ist, ist m jedoch -2, -1, 0, 1 und 2.
4. Spinquantenzahl(en)
Wenn die vorherige Zahl die Orientierung der Orbitale angibt, beschreibt diese Zahl den Spin des Elektrons, der Werte von 1/2 und -1/2 hat.
Lesen: Quantenmechanik
Orbitale und Quantenzahlen
Jedes Atomorbital hat einen einzigartigen Satz von drei Quantenzahlen. Diese Zahlen sind die Hauptquantenzahl (n), Azimut oder Drehimpuls (l) und magnetisch (m). Diese drei Zahlen veranschaulichen mehrere Dinge.
Dazu gehören die Beschreibung des Energieniveaus der Orbitale, Größe, Form und Ausrichtung der möglichen radialen Verteilung von Atomorbitalen. Dann gibt es die Spinzahl (s), eine Zahl, die Ihnen den Spin eines Elektrons in einem Orbital angibt.
Atomorbitalform
Es gibt vier Formen von Atomorbitalen basierend auf ihren Azimut-Zahlwerten. Die vier Orbitalformen sind wie folgt.
1. s-Orbitale
Das s-Orbital ist ein Orbital mit l = 0. Es ist kugelförmig, mit dem Atomkern in der Mitte. Da die Kugel nur eine Orientierung hat, haben alle S-Orbitale nur einen Wert von m, dh m = 0. Das 1s-Orbital hat die höchste Elektronendichte bzw. Dichte im Atomkern.

Die Atomdichte nimmt dann langsam ab, wenn sie sich vom Atomkern entfernt. Das 2s-Orbital hat zwei Bereiche mit hoher Elektronendichte. Von den beiden Regionen gibt es einen kugelförmigen Knoten, an dem die Wahrscheinlichkeit, in dieser Region auf Elektronen zu treffen, auf Null abnimmt.
Das Muster der zunehmenden s-Orbitalscheitel wird mit den 4s, 5s und so weiter fortgesetzt.
2. p. Orbitale
Das p-Orbital ist ein Orbital mit l = 1. Die Form ist wie ein gedrehter Ballon, der mit zwei Lappen ausgestattet ist. Die Lappen befinden sich auf gegenüberliegenden Seiten des Atomkerns. Der Atomkern liegt in der Ebene des p-Orbitalknotens, zwischen den beiden Lappen mit hoher Elektronendichte.

Das p-Orbital hat drei Arten von räumlicher Orientierung, nämlich Px, Py und Pz, also gibt es drei mögliche Werte von m, nämlich -1, 0 oder +1. Die drei Orbitale sind senkrecht zueinander auf den x-, y- und z-Achsen in kartesischen Koordinaten angeordnet. Die Form, Größe und Energie sind gleich.
3. d orbital
Das d-Orbital ist ein Orbital mit l = 2. Dieses Orbital hat fünf verschiedene Orientierungen, was ihm fünf mögliche Werte von m gibt, nämlich -2, -1, 0, +1 oder +2. Die vier d-Orbitale davon sind dxy, dxz, dyx und d2-y2.
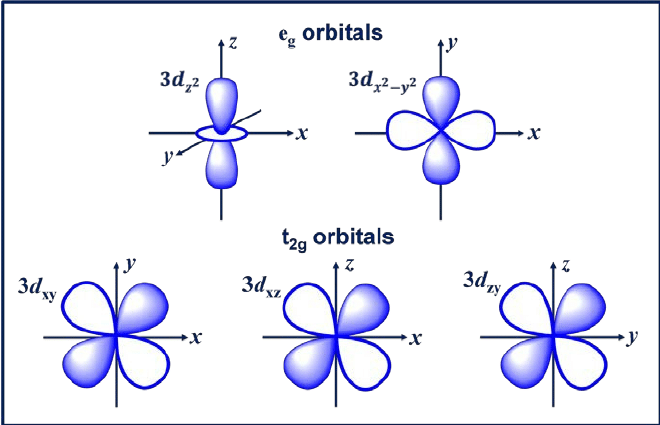
Diese Orbitale haben vier Lappen, die wie Kleeblätter geformt sind. Das nächste d-Orbital ist dzw, die zwei Hauptkeulen auf der z-Achse und einen ringförmigen Abschnitt in der Mitte hat.
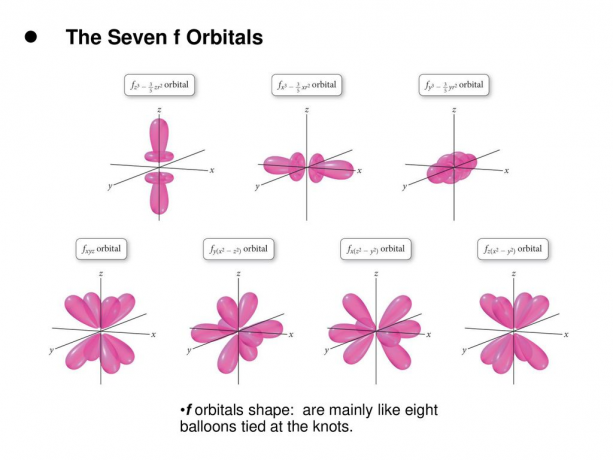
4. f. Orbitale
Das f-Orbital ist ein Orbital mit l = 3. Dieses Orbital hat sieben Orientierungstypen, ebenso wie es sieben mögliche Werte von m gibt (2l + 1 = 7). Alle f-Orbitale haben komplexe Formen mit einer unterschiedlichen Anzahl von Lappen.
Lesen: Elektronenkonfiguration
Elektronenkonfiguration
Nachdem Sie die Beziehung zwischen der Existenz von Elektronen in Atomen und Orbitalen in der Atomtheorie der Quantenmechanik verstanden haben, Als nächstes lernen Sie die Elektronenkonfiguration kennen, wie man Elektronen in Orbitalen in Atomhüllen anordnet Multi-Elektron.
1. Aufbaus Regel
Anzeige
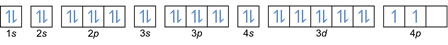
In dieser Regel heißt es, dass Elektronen von niedrigeren zu höheren Energieniveaus gefüllt werden müssen. Die Energieniveaus der Orbitale können in der Anordnung der Atome im Periodensystem der chemischen Elemente gesehen werden.
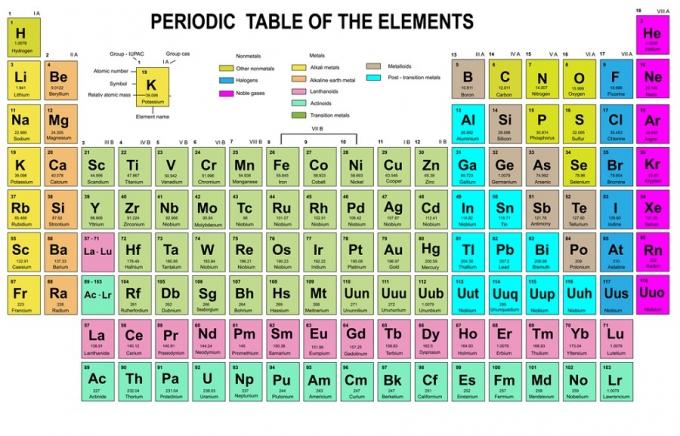
In der Tabelle ist unten links rot geschrieben, wo ein s-Block ist, blau ist für Block d, gelb ist für Block p und grün ist für Block f. Während jede Reihe eine Haut ist.
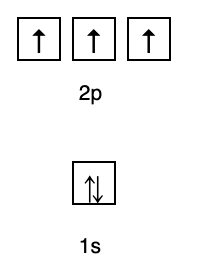
Basierend auf dieser Anordnung können Sie sehen, dass die Reihenfolge der Energieniveaus 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p und so weiter ist.
2. Hund-Regeln
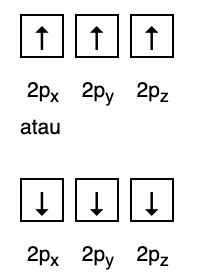
Diese Regel besagt, dass, wenn es Orbitale auf demselben Energieniveau gibt, die Elektronen es sein müssen parallel gefüllt, bis alle Orbitale im gleichen Energieniveau mit Elektronen gefüllt sind, wie in Abb folgende.
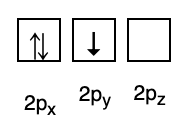
In der Zwischenzeit entspricht die folgende Abbildung nicht der Füllung nach der Hundschen Regel.
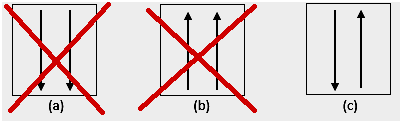
3. Paulis Sperre
Das Pauli-Verbot besagt, dass Elektronen beim Auffüllen eines Orbitals nicht die gleiche Quantenzahl haben können, daher gibt es eine Spinzahl (s) mit einem Wert von +1/2. Die niedrigste Energie ist diejenige mit der höchsten Anzahl gepaarter Elektronen und paralleler Spins.
4. Anomalie

Experimentell gibt es Anomalien in der Elektronenkonfiguration nach den oben genannten Regeln. Die d-Unterschale ist normalerweise halb voll oder voll. Zum Beispiel für 24Cr, seine Elektronenkonfiguration: [Ar] 4s1 3d5, ist stabiler als [Ar] 4s2 3d4.
Außerdem ist die Elektronenkonfiguration z 29Cu: [Ar] 4s1 3d10, stabiler als [Ar] 4s2 3d9. Inzwischen ist die Elektronenkonfiguration für einatomige Ionen wie K+, N / A+, Ca2+, Br–, S2-, usw. zuerst durch das neutrale Atom bestimmt werden.
Für positiv geladene Kationen oder Ionen ist einatomiges Ax+ mit einer Ladung von x+, dann werden bis zu x Elektronen aus der äußeren Elektronenhülle des neutralen Atoms A entfernt. Was das Anion angeht, einatomiges By- bei einer y-Ladung werden y Elektronen in das noch nicht volle Orbital mit der niedrigsten Energie eingefangen.
Wie man Quantenzahlen bestimmt
Bevor Sie die Zahl bestimmen, müssen Sie zuerst die Elektronenkonfiguration des Elements erstellen, für das Sie den Quantenwert finden möchten. Zum Beispiel ist 16S. Seine Elektronenkonfiguration ist 1s2 2s2 2p6 3 Sek2 3p4. Nehmen Sie danach die letzte Elektronenkonfiguration, die 3p ist4.
- Basierend auf dieser Konfiguration ist der Hauptzahlwert 3, da die Zahl 3 die Größe des Orbitals oder der Hülle darstellt.
- p ist eine Unterschale des Elektrons, kann also unter dem Wert l = 1 erhalten werden.
- Da es sich in der p-Unterschale befindet, liegt die Quantenzahl zwischen -1, 0 oder +1. Um es zu bestimmen, zeichnen Sie zuerst die Orbitalbox. Sie können die Pfeile verwenden, wenn Sie das Feld füllen.
- Füllen Sie jedes Kästchen mit einem nach oben zeigenden Pfeil aus, und füllen Sie es dann mit einem nach unten zeigenden Pfeil aus. Die Zahl 4 ist die Anzahl der Pfeile, die gefüllt werden müssen, um dann so zu erhalten.
↑↓ ↑ ↑
-1 0 +1
- Der vierte (letzte) Pfeil befindet sich im Feld -1, wo der mechanische Wert m = -1 ist.
- Der Aufwärtspfeil ist +1/2 wert, während der Abwärtspfeil -1/2 wert ist. Der letzte Pfeil zeigt nach unten, also ist der Wert von s = -1/2.
Nun, so bestimmt man die Quantenzahl. Hier sind einige Beispiele für Fragen zu diesem Material, die Sie studieren können.
Lesen: Körperliche Veränderung
Beispiele für Quantenzahlen

Schauen Sie sich die folgenden Fragen an!
1. Beispielfrage 1
Bestimmen Sie die Elektronenkonfigurationen und Elektronendiagramme der folgenden Elemente und einatomigen Ionen!
- 8Ö2-
- 20mg2+
- 26Fe3+
- 27Co
- 32Ge
Lösung:
- Elektronenkonfiguration 8O2:1s2 2s2 2p4 oder [Er] 2s2 2p4
Elektronenkonfiguration 8O2–: 1s2 2s2 2p6 oder [Er] 2s2 2p6 oder [Ne] (plus 2 Elektronen: 2s2 2p4+2)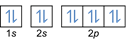
- Elektronenkonfiguration 20mg: 1 s2 2s2 2p6 3 Sek2 3p6 4s2 oder [Ar] 4s2
Elektronenkonfiguration 20mg2+: 1s2 2s2 2p6 3 Sek2 3p6 oder [Ar] (2 Elektronen von der äußeren Schale abziehen: 4s2-2)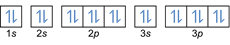
- Elektronenkonfiguration 26Fe: 1s2 2s2 2p6 3 Sek2 3p6 4s2 3d6 oder [Ar] 4s2 3d6
Elektronenkonfiguration 26Fe3+: 1s2 2s2 2p6 3 Sek2 3p6 3d5 oder [Ar]3d5 (3 Elektronen von der äußeren Schale abziehen: 4s2-2 3d6-1)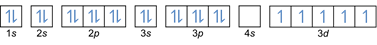
- Elektronenkonfiguration 27Co: 1s2 2s2 2p6 3 Sek2 3p6 4s2 3d7 oder [Ar] 4s2 3d7
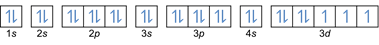
- Elektronenkonfiguration 32Ge: 1s2 2s2 2p6 3 Sek2 3p6 4s2 3d10 4p2 oder [Ar] 4s2 3d10 4p2
2. Beispielfrage 2
Das letzte Elektron in Ga hat eine Quantenzahl...
- n = 4; l = 0
- n = 4; l = 1
- n = 3; l = 2
- n = 4; l = 2
- n = 3; l = 1
Lösung:
Wenn Sie sich das chemische Periodensystem der Elemente ansehen, befindet sich das Element Ga in Periode IV, was ihm ein n = 4 gibt. Gallium ist in Gruppe 13, also sind die Valenzelektronen in der p-Unterschale, was bedeutet, dass l = 1 ist.
3. Beispielfrage 3
Unten ist die Quantenzahl, die nicht vom letzten Elektron des Cl-Atoms besetzt werden kann, ...
- n = 3; l = 1; m = -1; s = -1/2
- n = 3; l = 1; m = 0; s =
- n = 3; l = 2; m = -1; s =
- n = 3; l = 2; m = 1; s = -1/2
- n = 3; l = 1; m = 1; s = 1/2
Lösung:
Da sich das Element Cl in Periode 3 befindet, ist n = 3. Cl ist auch eine Gruppe 17, also befinden sich seine Valenzelektronen in der p-Unterschale, also ist l = 1. Der Wert von m kann -1, 0 oder +1 sein, da die Energien der drei Quantenzahlen gleich sind und die Reihenfolge der Füllung keine Rolle spielt.
Denn s kann auch -1/2 oder 1/2 wert sein, daher können wir m und s nicht mit Sicherheit bestimmen.
4. Beispielfrage 4
Ein Element X3+ hat die gleiche Elektronenkonfiguration wie das Element Ar. Das Ion, das die gleiche Konfiguration wie das Ion hat, ist also ...
- K+
- mg2+
- N / A+
- Kl+
- F–
Lösung:
Das Element Ar ist in Periode 3, also das Ion mit der gleichen Elektronenkonfiguration wie Ar oder [Ne] 3s2 3p6 wird in Periode 4 für Kationen und in Periode 3 für Anionen sein. Das geeignetste Ion ist K+.
5. Beispielfrage 5
Bestimmen Sie die Quantenzahl des Elements 32Ge!
Lösung:
Elektronenkonfiguration 32Ge: 1s2 2s2 2p6 3 Sek2 3p6 4s2 3d10 4p2 oder [Ar] 4s2 3d10 4p2.
Die letzte Konfiguration ist 4p2. Das Energieniveau ist 4 und befindet sich in der p-Unterschale, also n = 4 und l = 1. 4p Orbitaldiagrammzeichnung2 um die anderen Zahlen wie folgt zu kennen.
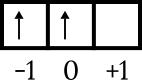
Das letzte Elektron befindet sich im Kastenorbital 0, der Pfeil zeigt nach oben, also m = 0 und s = +1/2.
6. Beispielfrage 6
Alle der folgenden sind erlaubte Quantenzahlen, außer...
- n = 2; l = 1; m = -1
- n = 3; l = 2; m = 1
- n = 3; l = 3; m = -1
- n = 3; l = 0; m = 0
- n = 3; l = 2; m = -1
Lösung:
Wenn der Wert der Hauptzahl (n) 3 ist, dann ist die maximale Azimutzahl (l) n-1 = 3-1 = 2. Daher sind Optionen C mit n = 3, l = 3 und m = -1 nicht zulässig.
Um Quantenzahlen zu lernen, müssen Sie auch einige Ordnungszahlen von Elementen beherrschen, die häufig verwendet werden oder in Problemen vorkommen. Außerdem sollten Sie mit der Anordnung der Energieniveaus beim Aufbau von Elektronenkonfigurationen vertraut sein.
X SCHLIESSEN
Anzeige
ANZEIGE
X SCHLIESSEN
