Støkiometriskemi: begreber, typer, eksempler på problemer
Indlæser...
Begrebet støkiometri er en videnskab inden for kemi, som er grundlaget for at beregne det kvantitative forhold mellem reaktanter og produkter, der opstår i kemiske reaktioner. Den er baseret på reaktionens ligning og de grundlæggende love.
Det karakteristiske ved støkiometriske reaktioner er, at der ikke er nogen rester fra reaktanterne eller reaktionerne, fordi de alle er brugt op. Generelt er dette materiale blevet undervist i gymnasiets klasse 10 og kommer ofte ud i forskellige skoleeksamener. Her er en fuldstændig forklaring.
Indholdsfortegnelse
Støkiometrisk kemi Materi
At studere støkiometri betyder at skulle forstå flere relaterede ting. Nogle af disse ting inkluderer de grundlæggende love for kemi, begreber i kemi, der er beslægtede, og deres typer. Der er også brug for øvelsesspørgsmål, så den forståelse, de har, er mere moden.
Grundlæggende love for kemi for støkiometri
Der er 5 grundlæggende love i kemi, som er vigtige at kende for at forstå støkiometri, herunder:
1. Loven om bevarelse af messen

I 1789 formulerede en kemiker ved navn Lavoisier loven om bevarelse af masse. Essensen af loven om bevarelse af masse er, at den samlede vægt, som et stof besidder, forbliver den samme, både før og efter en kemisk reaktion.
For eksempel ændres træmassen, før den brændes, med massen af resultatet af brænding ikke. Med andre ord bevares massen af et stof eller en genstand, der er i besiddelse af før og efter en reaktion finder sted.
2. Lov om fast sammenligning

Joseph Proust var en ekspert, der skabte loven om faste proportioner i 1799. Denne lov siger, at forholdet mellem den samlede vægt af de elementer, der udgør en bestemt forbindelse, ikke vil ændre sig eller forblive konstant.
Som en illustration er forholdet mellem masserne af stof A og stof B indeholdt i en opløsning altid konstant og påvirkes slet ikke af opløsningens rumfang.
3. Lov om multipel sammenligning

Desuden er den grundlæggende lov om støkiometri, der skal forstås, loven om multiple forhold lavet af John Dalton i 1803. Flere sammenligninger er en udvidelse af loven om konstant sammenligning.
Loven om flere proportioner siger, at når 2 grundstoffer danner mere end 2 forbindelser, er deres samlede vægt et af de konstituerende elementer er konstant, så er den samlede vægt af de andre bestanddele et helt tal enkel.
4. Gay Lussacs lov
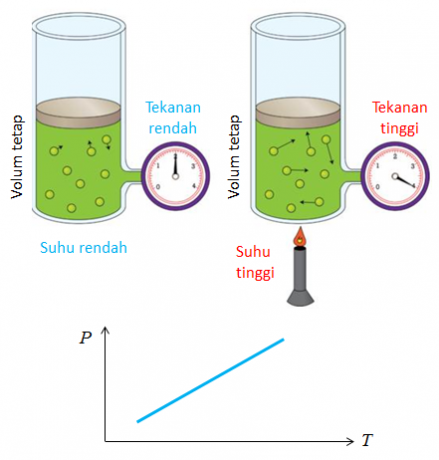
Et andet navn for loven opdaget af Joseph Gay Lussac er loven om forholdet mellem volumener. Konklusionen fra loven om volumensammenligning er, at temperatur og tryk påvirker ændringen i gasvolumen.
5. Avogadro .'s hypotese
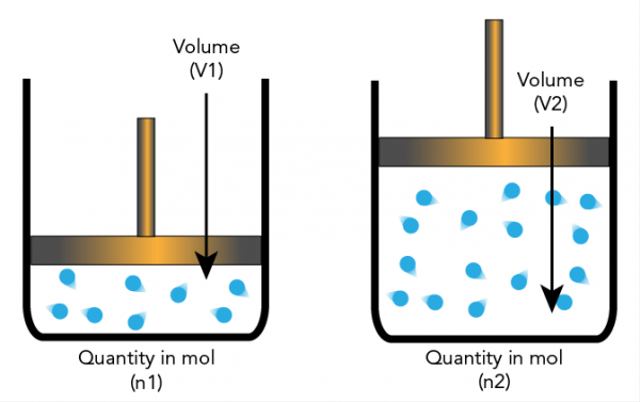
Amadeo Avogadro fremsatte en hypotese om, at elementarpartikler kan være molekyler og grundstoffer, så de ikke altid er atomer. Dette fører til yderligere forklaringer, som støkiometri er baseret på.
Avogadros hypotese siger, at hvis temperatur og tryk har samme antal, så vil forholdet mellem gasser med samme volumen have det samme antal molekyler.
Læs: Kolloidt materiale
Kemiske begreber at forstå i støkiometri
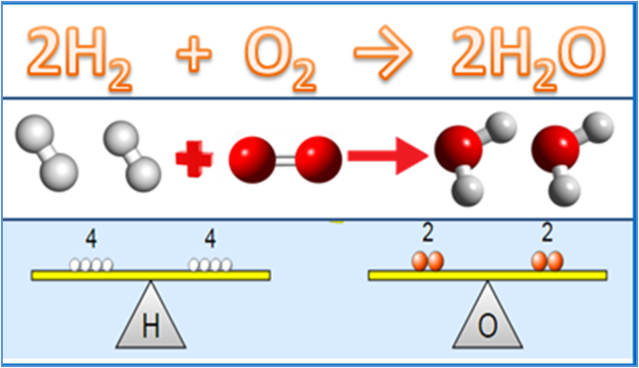
Ikke kun grundlæggende love, andre vigtige ting, der er tæt forbundet med støkiometrisk materiale, er begreber i kemi. Der er i hvert fald 4 begreber, der skal forstås, nemlig relativ atommasse, relativ molekylmasse, molaritet og begrebet mol.
1. Relativ atommasse (Ar)
I kemi er forkortelsen for relativ atommasse Ar. Dette koncept refererer til den samlede atomvægt, som bestemmes ved at sammenligne den med den standard atomare totalvægt. International Union of Pure and Applied Chemistry bruger carbonatomet som standard for bestemmelse.
Kulstofatomet eller C-12 isotopen blev valgt, fordi det har en stabil kerne, som er mere inert end andre typer atomer. Inert refererer til modstanden mod kemiske reaktioner, der opstår.
2. Relativ molekylær masse (Mr)
Desuden er der begrebet relativ molekylær masse, som forkortes som Mr. Konceptet med støkiometri Mr er den samlede vægt af et molekyle, hvis måling er ved hjælp af atommasseenheder.
Reklame
Baseret på dette koncept har forskellige molekyler med den samme forbindelse mulighed for forskelle i molekylvægt, fordi de isotoper, de indeholder, er fra forskellige grundstoffer.
3. Mol koncept
Kemi har en regningsenhed til at forenkle beregningsprocessen, nemlig muldvarpen. Molekonceptet er baseret på Avogadros tal for at repræsentere antallet af molekyler, atomer eller ioner. Ifølge dette koncept svarer 1 mol til 6.022 x 1023 stoffets partikler.
Massen af en mol kan siges at svare til Ar og Mr i gram. For eksempel er den samlede vægt af den molære masse af kulstof 12 g/mol lig med Ar af kulstof 12 amu.
4. Molaritet
Molaritet er et begreb inden for kemi, der angiver antallet af mol opløst stof i 1 liter opløsningsmiddel. Med andre ord refererer molaritet til den koncentration, som mængden af opløst stof pr. volumenenhed besidder.
Læs: Molaritetsformel
Typer af kemisk støkiometri

Bemærk venligst, at der er 3 typer støkiometri, nemlig reaktioner, gasser og forbindelser eller sammensætninger. Her er en fuldstændig forklaring:
1. Reaktionsstøkiometri
Definitionen af reaktionsstøkiometri er en type begreb, der understreger det kvantitative forhold mellem stoffer, der er til stede i en bestemt kemisk reaktion. Dette koncept bruges til at afbalancere de kemiske ligninger, der opstår.
Ud fra denne forklaring kan man sige, at de stoffer, der deltager i en kemisk reaktion, påvirker det kvantitative forhold mellem disse stoffer.
2. Gasstøkiometri
Dernæst refererer gasstøkiometri til begrebet kemiske reaktioner, hvor gasser er til stede. En gas ved et bestemt tryk, temperatur og volumen betragtes som en ideel gas. Gassen består kun af ét sæt partikler, hvis bevægelse er tilfældig og ikke interagerer.
Den ideelle gasligning er udtrykt ved P.V = n. R.T. I formlen er P trykket i atm, V er volumenet af gassen i liter, n er antallet af mol, T er temperaturen på 273 K og R er gassen 0,082 L atm/mol K.
3. Sammensat støkiometri
Definitionen af støkiometri af en forbindelse eller sammensætning er et begreb, der udtrykker det kvantitative forhold mellem den samlede vægt eller mængden af stof, som grundstofferne i en bestemt forbindelse har.
Dette koncept bruges ofte til at forklare den samlede vægt af brint og nitrogen, der er kombineret for at danne kompleks ammoniak.
Læs: Densitetsformel
Eksempler på støkiometriproblemer og diskussion

Hvordan man løser problemer relateret til støkiometri. Følgende er et eksempel på et spørgsmål og dets diskussion for at gøre det lettere at forstå:
1. Find antallet af hvert atom indeholdt i 2 mol H2O!
Det skal bemærkes, at H2O har 2 H-atomer og 1 O-atomer. Så bliver løsningen:
Antallet af H-atomer = 2 2 mol 6,02. 1023 atomer/mol = 24,08. 1023 atom. Så antallet af atomer indeholdt i 2 mol H er 24,08. 1023.
Tæl nu bare antallet af atomer, der ejes af O-atomet, nemlig:
Antallet af O-atomer = 1 2 mol 6,02. 1023 atomer/mol = 12,04. 1023 atom. Ud fra disse beregninger kan det ses, at antallet af atomer i 2 mol O er 12,04. 1023.
2. Beregn den samlede vægt eller masse, som 2 mol C besidder6H12O6 (glukose)! Det er også kendt, at summen af Ar C = 12, O = 16 og H = 1.
Løsningen:
Fra spørgsmålet kan det ses følgende information:
n = 2 mol
hr. C6H12O6 = (6 Ar C) + (12 1) + (6 16)
= 180
Dernæst bliver udregningen:
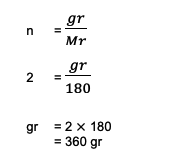
Så den samlede vægt af 2 mol glucose eller C6H12O6 hele 360 gram baseret på disse beregninger.
Et af de vigtige emner i kemi er støkiometri, som er det grundlæggende begreb for beregning for at finde ud af det kvantitative forhold mellem kemiske ligninger og formler. Flere andre begreber inden for kemi skal også forstås, fordi de er relateret til støkiometri.
X LUK
Annoncer
REKLAME
X LUK
