Materiál kvantového čísla: typy, příklady problémů (souhrn)
Načítání...
Při zjednodušeném vysvětlení je kvantové číslo číslo, které popisuje polohu elektronů a energetických hladin resp vzdálenost od atomového jádra najednou, tvar orbitalů, orientace orbitalů a spin elektronů obsažených v mechanickém atomovém modelu Kvantová.
Každý atom má orbital a atomové orbitaly mají různé energetické hladiny. Energetická hladina stejného orbitalu bude mít jinou energetickou hladinu, pokud jsou atomy různé, takže 1s orbital pro vodík se liší energetickou hladinou od 1s orbital pro helium.
Seznam obsahu
Definice kvantových čísel

Ve vlnové funkci má toto číslo zvláštní význam pro popis stavu kvantové situace. Tato čísla mohou popisovat stav elektronů v atomu. V roce 1926 navrhl Erwin Schrodinger Teorii kvantové mechaniky.
Tato teorie vysvětluje strukturu atomu. Tento kvantově mechanický atomový model je vyjádřen v matematické rovnici, konkrétně vlnové rovnici. Řešení rovnice pro atom vodíku dává vlnovou funkci nebo atomový orbital.
Tento atomový orbital bude popisovat situaci kvantového počtu elektronů v atomu. Druhá mocnina vlnové funkce znamená, že existuje vysoká pravděpodobnost získání elektronu v daném objemu prostoru kolem atomového jádra.
Stejně jako u Heisenbergova principu nejistoty nelze polohu elektronů v atomech určit. Jediné, co lze znát, je poloha, kde se elektron s největší pravděpodobností nachází.
Typy kvantových čísel
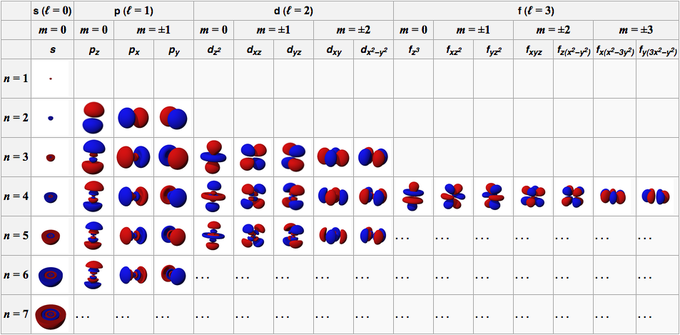
Orbital atomu je tvořen z vlnových funkcí, které tvoří orbital. Za obecných podmínek jsou orbitální charakteristiky atomu popsány čtyřmi čísly, konkrétně n, l, m a s.
1. Hlavní kvantové číslo (n)
Toto číslo se skládá z kladných celých čísel počínaje 1 (jedna), takže hodnota n je 1, 2, 3, 4, 5 atd. Toto číslo odkazuje na obal obsazený orbitalem v atomu.
2. Kvantové číslo azimutu (l)
Toto číslo se skládá z kladných celých čísel počínaje 0 (nulou), takže hodnota l je 0, 1, 2, 3, 4, 5 atd. Tato čísla mají své vlastní znaménko; 0 je orbital s, 1 je orbital p, 2 je orbital d a 3 je orbital f.
3. Magnetické kvantové číslo (m)
Toto číslo se skládá z celých čísel od 0 (nuly) do +/- 1, takže číselná hodnota pro každý orbital není stejná. Pro orbital s je potom m 0, protože je v orbitalu s, pak l je 0. Nicméně pro d orbitaly, kde l je 2, pak m je -2, -1, 0, 1 a 2.
4. Spin kvantová čísla
Pokud předchozí číslo označuje orientaci orbitalů, toto číslo popisuje spin elektronu, který má hodnoty 1/2 a -1/2.
Číst: Kvantová mechanika
Orbitaly a kvantová čísla
Každý atomový orbital má jedinečnou sadu tří kvantových čísel. Tato čísla jsou hlavní kvantové číslo (n), azimut nebo moment hybnosti (l) a magnetické (m). Tato tři čísla ilustrují několik věcí.
Patří mezi ně popis energetické hladiny orbitalů, velikosti, tvaru a orientace možného radiálního rozložení atomových orbitalů. Pak je tu spinové číslo (s), číslo, které vám říká rotaci elektronu v orbitalu.
Atomový orbitální tvar
Existují čtyři formy atomových orbitalů na základě jejich číselných hodnot azimutu. Čtyři orbitální formy jsou následující.
1. s orbitaly
Orbital s je orbital s l = 0. Má kulovitý tvar, s atomovým jádrem uprostřed. Protože koule má pouze jednu orientaci, všechny orbitaly S mají pouze jednu hodnotu m, tj. m = 0. Orbital 1s má nejvyšší elektronovou hustotu nebo hustotu v atomovém jádře.

Atomová hustota pak pomalu klesá, jak se vzdaluje od atomového jádra. Orbital 2s má dvě oblasti s vysokou hustotou elektronů. Ze dvou oblastí je kulový uzel, kde pravděpodobnost setkání s elektrony v této oblasti klesá k nule.
Vzor rostoucích orbitálních vrcholů s bude pokračovat se 4s, 5s, a tak dále.
2. p. orbitaly
Orbital p je orbital s l = 1. Tvar je jako zkroucený balónek, vybavený dvěma laloky. Laloky jsou na opačných stranách atomového jádra. Atomové jádro je v rovině orbitálního uzlu p, mezi dvěma laloky s vysokou elektronovou hustotou.

Orbital p má tři typy prostorové orientace, a to Px, Py a Pz, takže existují tři možné hodnoty m, a to -1, 0 nebo +1. Tyto tři orbitaly jsou umístěny navzájem kolmo na osách x, y a z v kartézských souřadnicích. Tvar, velikost a energie jsou stejné.
3. d orbitální
Orbital d je orbital s l = 2. Tento orbital má pět různých orientací, což mu dává pět možných hodnot m, konkrétně -2, -1, 0, +1 nebo +2. Čtyři orbitaly d, z nichž jsou dxy, dxz, dyx a d2-y2.
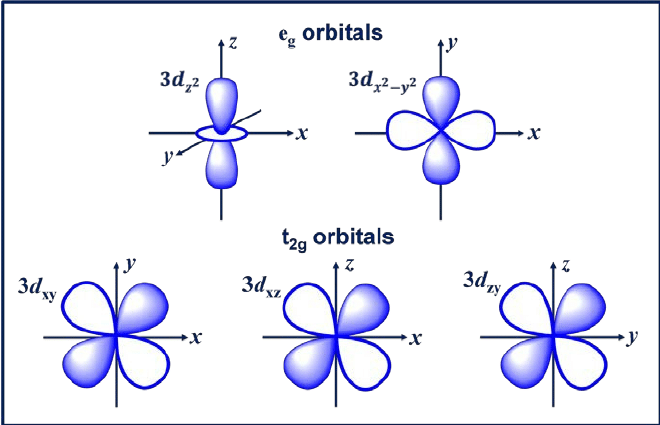
Tyto orbitaly mají čtyři laloky, které mají tvar čtyřlístku. Další orbital d je dzw, který má dva hlavní laloky na ose z a jeden koblihovitý úsek uprostřed.
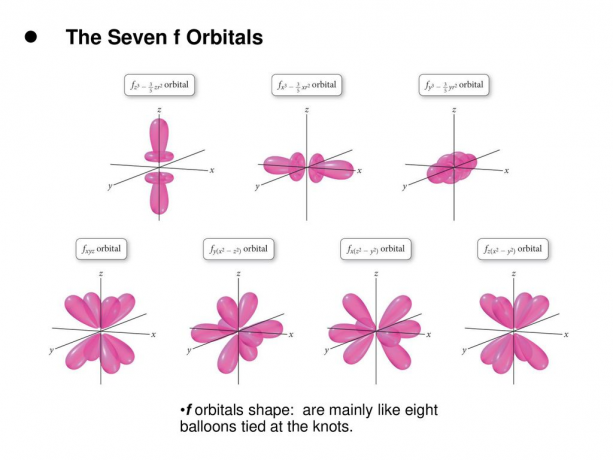
4. f. orbitaly
Orbital f je orbital s l = 3. Tento orbital má sedm typů orientace, stejně jako existuje sedm možných hodnot m (2l + 1 = 7). Všechny f orbitaly mají složité tvary s různým počtem laloků.
Číst: Konfigurace elektronů
Konfigurace elektronů
Poté, co pochopíte, jaký je vztah mezi existencí elektronů v atomech a orbitalech v atomové teorii kvantové mechaniky, Dále se dozvíte o elektronové konfiguraci, jak uspořádat elektrony v orbitalech v atomových obalech víceelektronový.
1. Aufbauovo pravidlo
reklama
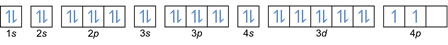
V tomto pravidle je uvedeno, že elektrony musí být naplněny od nižších energetických hladin k vyšším. Energetické hladiny orbitalů lze vidět v uspořádání atomů v periodické tabulce chemických prvků.
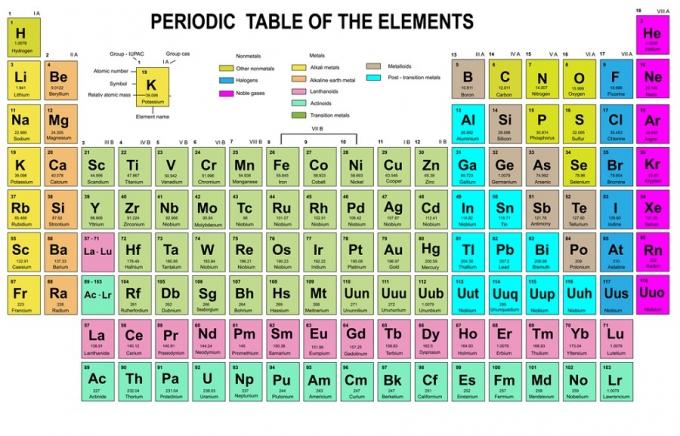
V tabulce je vlevo dole zapsáno červeně tam, kde je blok s, modrá je pro blok d, žlutá pro blok p a zelená pro blok f. Zatímco každý řádek je kůže.
Na základě tohoto uspořádání můžete vidět, že pořadí energetických úrovní je 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p a tak dále.
2. Hundova pravidla
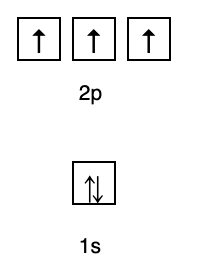
Toto pravidlo říká, že pokud existují orbitaly na stejné energetické úrovni, pak elektrony musí být naplněné paralelně, dokud nebudou všechny orbitaly na stejné energetické hladině naplněny elektrony, jak je znázorněno na obr Následující.
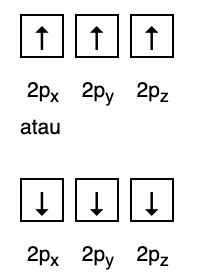
Mezitím následující obrázek neodpovídá náplni podle Hundova pravidla.
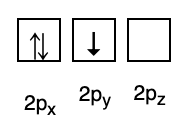
3. Pauliho zákaz
Pauliho zákaz říká, že elektrony nemohou mít stejné kvantové číslo, když jsou vyplněny v orbitalu, takže existuje spinové číslo (s) s hodnotou +1/2. Nejnižší energie je ta s nejvyšším počtem spárovaných elektronů a paralelních spinů.
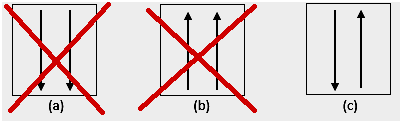
4. Anomálie

Podle experimentů existují anomálie v elektronové konfiguraci podle výše uvedených pravidel. Subshell d je obvykle poloplný nebo plný. Například pro 24Cr, jeho elektronová konfigurace: [Ar] 4s1 3d5, je stabilnější než [Ar] 4s2 3d4.
Navíc elektronová konfigurace pro 29Cu: [Ar] 4s1 3d10, stabilnější než [Ar] 4s2 3d9. Mezitím elektronová konfigurace pro monatomické ionty, jako je K+, Na+, Ca2+, Br–, S2-a tak dále mohou být určeny nejprve neutrálním atomem.
Pro kladně nabité kationty nebo ionty, monatomický Ax+ s nábojem x+ se pak z vnějšího elektronového obalu neutrálního atomu A odstraní až x elektronů. Pokud jde o anion, monatomický By- s nábojem y je zachyceno až y elektronů v orbitálu s nejnižší energií, který ještě není plný.
Jak určit kvantová čísla
Před určením čísla musíte nejprve provést elektronovou konfiguraci prvku, pro který chcete zjistit kvantovou hodnotu. Například je 16S. Jeho elektronová konfigurace je 1s2 2s2 2p6 3s2 3p4. Poté vezměte poslední elektronovou konfiguraci, což je 3p4.
- Na základě této konfigurace je hodnota hlavního čísla 3, protože číslo 3 představuje velikost orbitalu nebo pláště.
- p je podslupkou elektronu, takže ho lze získat pod hodnotou l = 1.
- Protože je v podslupce p, kvantové číslo bude mezi -1, 0 nebo +1. Při jeho určování nejprve nakreslete orbitální schránku. Při vyplňování krabice můžete použít šipky.
- Vyplňte každé pole šipkou směřující nahoru a poté jej vyplňte šipkou směřující dolů. Číslo 4 je počet šipek, které je třeba vyplnit, abyste je získali takto.
↑↓ ↑ ↑
-1 0 +1
- Čtvrtá (poslední) šipka je v poli -1, kde mechanická hodnota je m = -1.
- Šipka nahoru má hodnotu +1/2, zatímco šipka dolů má hodnotu -1/2. Poslední šipka směřuje dolů, takže hodnota s = -1/2.
No a takhle určit kvantové číslo. Zde je několik příkladů otázek souvisejících s tímto materiálem, které si můžete prostudovat.
Číst: Fyzická změna
Příklady kvantových čísel

Podívejte se na následující otázky!
1. Příklad otázky 1
Určete elektronové konfigurace a elektronové diagramy následujících prvků a monatomických iontů!
- 8Ó2-
- 20Mg2+
- 26Fe3+
- 27spol
- 32Ge
Řešení:
- Konfigurace elektronů 8O2:1s2 2s2 2p4 nebo [On] 2s2 2p4
Konfigurace elektronů 8O2–: 1s2 2s2 2p6 nebo [On] 2s2 2p6 nebo [Ne] (plus 2 elektrony: 2s2 2p4+2)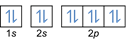
- Konfigurace elektronů 20Mg: 1s2 2s2 2p6 3s2 3p6 4s2 nebo [Ar] 4s2
Konfigurace elektronů 20Mg2+: 1s2 2s2 2p6 3s2 3p6 nebo [Ar] (odečtěte 2 elektrony od vnějšího obalu: 4s2-2)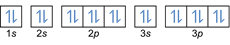
- Konfigurace elektronů 26Fe: 1s2 2s2 2p6 3s2 3p6 4s2 3d6 nebo [Ar] 4s2 3d6
Konfigurace elektronů 26Fe3+: 1s2 2s2 2p6 3s2 3p6 3d5 nebo [Ar]3d5 (odečtěte 3 elektrony od vnějšího obalu: 4s2-2 3d6-1)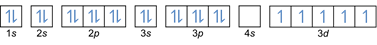
- Konfigurace elektronů 27Co: 1s2 2s2 2p6 3s2 3p6 4s2 3d7 nebo [Ar] 4s2 3d7
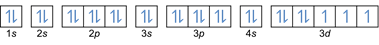
- Konfigurace elektronů 32Ge: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p2 nebo [Ar] 4s2 3d10 4p2
2. Příklad otázky 2
Poslední elektron v Ga má kvantové číslo...
- n = 4; l = 0
- n = 4; l = 1
- n = 3; l = 2
- n = 4; l = 2
- n = 3; l = 1
Řešení:
Pokud se podíváte na chemickou periodickou tabulku prvků, prvek Ga je v období IV, což mu dává n = 4. Gallium je ve skupině 13, takže valenční elektrony jsou v podslupce p, což znamená l = 1.
3. Příklad otázky 3
Níže je kvantové číslo, které nemůže být obsazeno posledním elektronem atomu Cl, je...
- n = 3; 1 = 1; m = -1; s = -1/2
- n = 3; 1 = 1; m = 0; s =
- n = 3; 1 = 2; m = -1; s =
- n = 3; 1 = 2; m = 1; s = -1/2
- n = 3; 1 = 1; m = 1; s = 1/2
Řešení:
Protože prvek Cl je v periodě 3, pak n = 3. Cl je také skupina 17, takže jeho valenční elektrony jsou v podslupce p, takže l = 1. Hodnota m může být -1, 0 nebo +1, protože energie tří kvantových čísel jsou stejné a na pořadí plnění nezáleží.
Neboť s může mít také hodnotu -1/2 nebo 1/2, takže m a s nemůžeme s jistotou určit.
4. Příklad otázky 4
Prvek X3+ má stejnou elektronovou konfiguraci jako prvek Ar. Takže iont, který má stejnou konfiguraci jako iont, je...
- K+
- Mg2+
- Na+
- Cl+
- F–
Řešení:
Prvek Ar je v periodě 3, takže iont má stejnou elektronovou konfiguraci jako Ar nebo [Ne] 3s2 3p6 bude ve 4. období pro kationty a ve 3. období pro anionty. Nejvhodnější iont je K+.
5. Příklad otázky 5
Určete kvantové číslo prvku 32Ge!
Řešení:
Konfigurace elektronů 32Ge: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p2 nebo [Ar] 4s2 3d10 4p2.
Poslední konfigurace je 4p2. Energetická hladina je 4 a je v podslupce p, takže n = 4 a l = 1. 4p. výkres orbitálního diagramu2 abyste znali další čísla následovně.
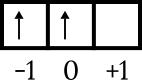
Poslední elektron je v orbitalu 0, šipka směřuje nahoru, takže m = 0 as = +1/2.
6. Příklad otázky 6
Všechna následující jsou povolená kvantová čísla, kromě...
- n = 2; 1 = 1; m = -1
- n = 3; 1 = 2; m = 1
- n = 3; 1 = 3; m = -1
- n = 3; l = 0; m = 0
- n = 3; 1 = 2; m = -1
Řešení:
Pokud je hodnota hlavního čísla (n) 3, pak maximální číslo azimutu (l) je n-1 = 3-1 = 2. Proto nejsou povoleny možnosti C s n = 3, l = 3 a m = -1.
Abyste se naučili kvantová čísla, musíte také ovládat některá atomová čísla prvků, která se často používají nebo se objevují v problémech. Kromě toho byste měli být obeznámeni s uspořádáním energetických hladin při konstrukci elektronových konfigurací.
X ZAVŘÍT
Reklamy
REKLAMA
X ZAVŘÍT
