مواد تفاعل الأكسدة والاختزال: المفاهيم والمعادلات والأمثلة
جار التحميل...
أمثلة على تفاعلات الأكسدة والاختزال التي قد نسمعها غالبًا عندما كنا في المدرسة الثانوية. تفاعل الأكسدة والاختزال هو تفاعل كيميائي يحدث نتيجة مزيج من تفاعلات الاختزال والأكسدة. لهذا المصطلح يصبح الأكسدة والاختزال (الأكسدة الاختزال)
يشمل هذا التفاعل جميع العمليات الكيميائية من الذرات إلى التغيرات في حالة عدد الأكسدة أو حالة الأكسدة. في تفاعل كيميائي كامل ، يتبع تفاعل الأكسدة هذا دائمًا تفاعل اختزال ، لذلك يُعرف باسم تفاعل الأكسدة والاختزال.
قائمة المحتويات
الاختزال والأكسدة

كما ذكرنا سابقًا ، تفاعلات الأكسدة والاختزال هي اختصار لتفاعلات الاختزال والأكسدة التي تحدث عند حدوث عملية كهروكيميائية.
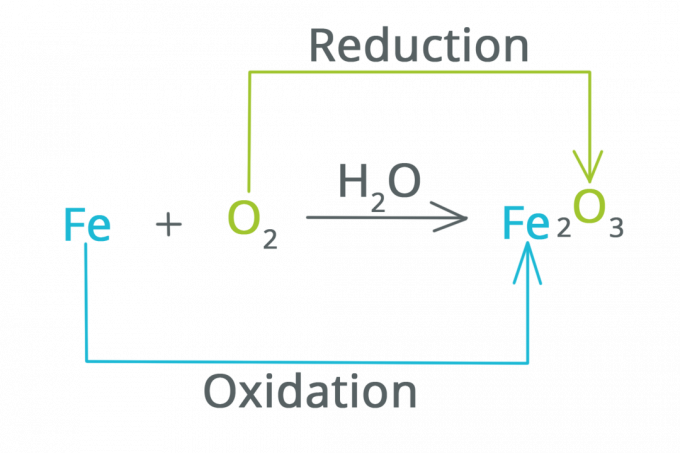
الاختزال هو تفاعل ينقص فيه عدد الأكسدة وتزيد الإلكترونات. يمكن القول أن الاختزال هو رد فعل يتسبب في فقدان مادة للأكسجين.
الأكسدة هي تفاعل يزداد فيه عدد الأكسدة وتنقص الإلكترونات. يمكن القول أن الأكسدة هي تفاعل ترتبط فيه مادة بالأكسجين.
اقرأ: سائل
رقم الأكسدة (أويلوكس)

يمكن أن يحدث مفهوم تفاعل الأكسدة والاختزال الذي يتضمن نقل الإلكترونات فقط في المركبات الأيونية ، بينما لا يحدث ذلك للمركبات التساهمية. لذلك ، ظهر مفهوم الأكسدة والاختزال الثالث ، وهو يعتمد على التغييرات في أرقام الأكسدة.
رقم الأكسدة هو الشحنة الموجبة والسالبة على الذرة. العناصر ذات حالات الأكسدة الإيجابية هي بشكل عام ذرات تحتوي على عناصر معدنية ، بينما بالنسبة للعناصر ذات حالات الأكسدة السالبة ، يتم استخدام الذرات غير المعدنية بشكل عام.
بناءً على مفهوم تغيير رقم الأكسدة ، هناك ثماني قواعد لتحديد هذا الرقم ، وهي:
- عدد أكسدة العناصر الحرة ذات الشكل الذري والجزيئي هو 0
- عدد أكسدة الأيونات أحادية الذرة ومتعددة الذرات وفقًا لنوع الشحنة على الأيون
- عدد أكسدة العناصر في المجموعات IA و IIA و IIIA وفقًا للمجموعة التي ينتمون إليها
- عدد الأكسدة لعناصر المجموعة الانتقالية أكثر من واحد
- مجموع أعداد أكسدة العناصر المكونة للأيون = كمية الشحنة التي يحتوي عليها
- عدد أكسدة الهيدروجين عند ربطه بمعدن = -1 ، بينما إذا كان مرتبطًا بعنصر غير معدني ، يكون +1
- عدد الأكسجين في مركبات البيروكسيد = -1 ، عدد أكسدة O في المركبات غير البيروكسيدية = -2
الاختزال والأكسدة

قبل مناقشة أمثلة على تفاعلات الأكسدة والاختزال ، لا يضر معرفة عوامل الاختزال والعوامل المؤكسدة أولاً. في تفاعل يتضمن تفاعل أكسدة واختزال مصحوب بتغيير في رقم الأكسدة.
العوامل المؤكسدة هي مواد يمكنها أكسدة المواد أو المواد الأخرى التي يتم تقليلها عند تفاعلها. بينما العامل المختزل هو مادة يمكن أن تقلل من المواد أو المواد الأخرى التي تخضع للأكسدة عند التفاعل.
اقرأ: صلب
خصائص تفاعل الأكسدة والاختزال
بالإضافة إلى أمثلة على تفاعلات الأكسدة والاختزال ، هناك أشياء أخرى يجب أن نعرفها وهي خصائص هذا التفاعل ، والخصائص التالية ، من بين أمور أخرى:
- هناك عوامل الاختزال والعوامل المؤكسدة
- هناك تغيير في حالة الأكسدة
- هناك عناصر حرة مثل الكلور والأكسجين والحبر وغيرها.
وظيفة تفاعل الأكسدة والاختزال

هناك وظائف مختلفة لتفاعلات الأكسدة والاختزال في الحياة اليومية ، وهي:
- لفهم عملية تآكل المعدن وكيفية الوقاية منه
- استخدام الحمأة المنشطة كمعالجة لمياه الصرف الصحي
- عملية التمثيل الضوئي للنبات
- رؤية أكسدة الطعام في الخلايا
- يتم طلاء البراغي والصواميل بطبقة من الزنك ، وفي هذه الطبقة توجد عملية أكسدة الزنك وتقليل الكاتيون
- صنع أواني المطبخ من الاستانلس ستيل حتى لا تصدأ
- تصنيع حامض الكبريتيك ومعالجة الخام للاحتياجات الصناعية.
معادلة تفاعل الأكسدة والاختزال

في الواقع ، يحدث تفاعل الأكسدة والاختزال هذا في المذيبات المائية ، لذا فإن المعادلة التي حصل عليها ستشمل أيونات H + و OH. هناك طريقتان تستخدمان لتعليمه ، وهما عن طريق عدد الأكسدة ونصف التفاعلات.
يمكن إجراء موازنة تفاعلات الأكسدة والاختزال عن طريق موازنة أرقام الأكسدة أو حالات الأكسدة ، سواء التفاعلات الجزيئية أو الأيونية. تعتمد طريقة الأكسدة هذه على "مجموع جميع المؤكسدات الإلكترونية يساوي إجمالي كمية المخفّض الإلكتروني"
أمثلة على تفاعلات الأكسدة والاختزال في الحياة اليومية

في أمثلة مشاكل تفاعل الأكسدة والاختزال ، غالبًا ما نجد أسئلة لذكر تفاعلات الأكسدة والاختزال في الحياة اليومية. فيما يلي أمثلة على تفاعلات الأكسدة والاختزال في الحياة اليومية ، وهي:
1. مبيض ملابس
التبييض مركب يمكنه إزالة اللون من الكائنات. على سبيل المثال ، المنسوجات. يرجع فقدان اللون الناتج عن التبييض إلى تفاعل الأكسدة.
العوامل المؤكسدة التي تُستخدم غالبًا في عوامل التبييض هي بيروكسيد الهيدروجين وهيبوكلوريت الصوديوم.
2. عملية التمثيل الضوئي للنبات
التمثيل الضوئي هو عملية تفاعل بيولوجي طبيعي للأكسدة والاختزال. التمثيل الضوئي في حد ذاته عملية معقدة للغاية.
يمكن للكائنات الحية من عملية التمثيل الضوئي استخدام الطاقة في ضوء الشمس لإنتاج السكر والأكسجين من تفاعلات الأكسدة والاختزال.
3. حرق البروبان
مثال آخر هو الاحتراق. في احتراق البروبان ، يحتوي الهواء على O2 ، بينما تتأكسد ذرات الكربون وتشكل ثاني أكسيد الكربون ، بينما يتحول الأكسجين إلى H2O.
اقرأ: مادة الغاز
أمثلة على مشاكل تفاعل الأكسدة والاختزال

الإعلانات
1. حدد حالة أكسدة العنصر في المركب SO42- و NaNO3
إجابه:
لذا42– = أيون متعدد الذرات
أوكسكس أيون متعدد الذرات = الشحنة الكلية = -2
Oxox O في المركب = -2
بلوك S + 4. حالة الأكسدة = -2
-6 + 4. (-2) = -2
لذا ، فإن عدد أكسدة S = -6 وعدد أكسدة O = -2.
نانو3 = مركب بدون شحنة
إجمالي حالة الأكسدة = 0
Oxox O في المركب = -2
Oxx of Na (معدن) = عدد إلكترونات التكافؤ = +1
حالة الأكسدة هي Na + رقم الأكسدة هو N + 3. حالة الأكسدة = 0
+1 + (+5) + 3. (-2) = 0
إذن ، حالة الأكسدة لـ Na = +1 ، حالة الأكسدة لـ N = +5 ، وحالة الأكسدة لـ O = -2
2. أي مما يلي هو العامل المؤكسد والعامل المختزل وعامل الاختزال ومنتج التفاعل الكيميائي التالي.
Fe + HCl → FeCl3 + ح2
إجابه:
عامل مؤكسد (مخفض) = حمض الهيدروكلوريك
عامل الاختزال (الذي يعاني من الأكسدة) = الحديد
منتج الأكسدة = FeCl3
نتيجة الاختزال = H2
3. وازن معادلات الأكسدة والاختزال التالية
ثنائية2ا3 + ClO– → 2BiO3– + Cl– (جو اللغة).
إجابه:
كيفية الأكسدة عدد
الشحنة اليسرى واليمنى متساوية: 2OH– + ثنائية2ا3 + ClO– → 2BiO3– + Cl–
نفس العدد من الذرات: 2 أوه– + ثنائية2ا3 + 2ClO– → 2BiO3– + 2 سل– + ح2ا
حتى التفاعل المكافئ: 2OH– + ثنائية2ا3 + 2ClO– → 2BiO3– + 2 سل– + ح2ا
طريقة نصف رد الفعل
الأكسدة والاختزال: ثنائية2ا3 + 2ClO– → 2BiO3– + 2 سل–
وازن الشحنة بإضافة OH– (قاعدة).
2 أوه– + ثنائية2ا3 + 2ClO– → 2BiO3– + 2 سل–
وازن عدد الذرات بإضافة H2س.
2 أوه– + ثنائية2ا3 + 2ClO– → 2BiO3– + 2 سل– + ح2ا
حتى التفاعل المكافئ: 2OH– + ثنائية2ا3 + 2ClO– → 2BiO3– + 2 سل– + ح2ا
دراسة أمثلة على تفاعلات الأكسدة والاختزال وحتى مناقشتها الكاملة ليس بالأمر السهل ، علاوة على ذلك ، هناك العديد من المركبات التي يجب حفظها في هذه المادة. لذلك ، لا تتردد في الاستمرار في الممارسة لفهمها جيدًا.
الإعلانات
X اغلاق
