مادة قانون فاراداي: الأصوات ، الصيغ ، أمثلة المشاكل
جار التحميل...
هل تعرف ما هو قانون فاراداي؟ أحد القوانين المتعلقة بالكهرومغناطيسية ويوفر تنبؤات بالتفاعلات بين الدوائر الكهربائية والمجالات المغناطيسية حتى تتمكن من إنتاج القوى الدافعة الكهربائية.
اكتشفه العالم البريطاني مايكل فاراداي عام 1833 ، ولا يزال يستخدم حتى الآن وهو مفيد للغاية في مجالات معينة. تريد أن تعرف ماذا يعني ومثال على السؤال؟
قائمة المحتويات
قانون فاراداي الأول

هناك نوعان من قوانين فاراداي ، الأول يتعلق بعملية التحليل الكهربائي والشحنة الكهربائية.
تقرأ "كتلة المادة المنتجة من قطب كهربائي أثناء عملية التحليل الكهربائي ستكون متناسبة طرديًا مع كمية الشحنة الكهربائية المستخدمة"
المعادلات المستخدمة هي:
دبليو كيو
W = كتلة المادة
س = الشحنة الكهربائية للإلكترونات
الاستخدامات هي:
س = أنا س ر
أنا = التيار الكهربائي (بالأمبير)
ر = الوقت (بالثواني)
مع توضيح أن مجموع استخدام الشحنات الكهربائية ، ستكون النتيجة مساوية لمنتج القوة الحالية مع الوقت.
علاوة على ذلك ، هناك المزيد من أوجه التشابه من نتائج استخدام القانون أعلاه ، لتصبح:
ث أنا س تا
أما الصيغة المستخدمة في تطبيقها فهي:
W = e.i.t / F.
معلومة:
W = كتلة مادة منتجة في عملية التحليل الكهربائي (بالجرام)
e = كتلة مكافئة
أنا = القوة الحالية (بالأمبير)
ر = الوقت (بالثانية)
F = عزيمة فاراداي برقم محدد 96500 كولوم / مول.
يمكن رؤية تطبيق قانون فاراداي في عالم الكيمياء من خلال العديد من المكونات المتعلقة بالتيار الكهربائي والتحليل الكهربائي.
كما في المولد الكهربائي وهو جهاز خاص بوظيفة توليد الطاقة الكهربائية من خلال مصادر ميكانيكية واستخدام الحث الكهرومغناطيسي. للمولدات نوعان ، هما التدفقات الحالية ذهابًا وإيابًا ومباشرة.
التطبيق التالي هو دينامو له نوعان ، وهما التيار المتردد والتيار المباشر.
اقرأ: قانون كيرشوف
قانون فاراداي الثاني

على عكس قانون فاراداي الأول ، هناك ثانية أخرى مع الصوت "كتلة المادة التي تنتجها سيكون القطب أثناء عملية التحليل الكهربائي متناسبًا طرديًا مع الكتلة المكافئة للمادة ال.
في حين أن المقصود من كتلة المادة هو كتلة المادة المطبقة على القانون. ثم الكتلة المكافئة هي كتلة مادة ، متكافئة لها نفس عدد المولات مثل 1 مول من الإلكترون.
المعادلة هي:
كتلة من كتلة مادة مكافئة للمادة
w ME
ME = حالة الأكسدة أو شحنة الأيون / Ar
الصيغة المستخدمة في تطبيق هذا القانون الثاني هي:
W1 / W2 = e1 / e2
معلومة:
W1 = كتلة المادة الأولى (بالجرام)
W2 = كتلة المادة الثانية (بالجرام)
e1 = الكتلة المكافئة للمادة الأولى
e2 = الكتلة المكافئة للمادة الثانية
في تطبيق هذا القانون الثاني ، تعتبر دالة الكتلة المكافئة مهمة جدًا. مقسومًا على التغير في رقم الأكسدة الذي يحدث في تفاعل التحليل الكهربائي.
المعادلة هي:
مبلوط = أر
تغيير في عدد الأكسدة
عند الإشارة إلى مفاهيم القياس المتكافئ الأساسية ، هناك علاقة بين الكتلة وعدد المو وكتلة الضرس والتي ستكون مرتبطة ارتباطًا وثيقًا بالاستخدام المشترك لقوانين فاراداي الأولى والثانية.
المعادلة هي:
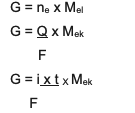
الملخص هو المعادلة المجمعة بين و 2 ، وهي:
الإعلانات
G ~ i x t x Mبلوط
معلومة:
G = كتلة المنتج (بالجرام)
س = الشحنة الكهربائية (بوحدات كولوم)
أنا = قوة التيار الكهربائي (بالأمبير)
ر = الوقت (بالثانية)
مبلوط= الكتلة المكافئة للمادة (بالجرام / مول)
F = ثابت فاراداي وهو 96500 كولوم / مول)
اقرأ: قانون هوك
مثال على مشكلة قانون فاراداي
لفهم تطبيق قانون فاراداي بشكل أفضل ، إليك بعض الأمثلة على تطبيقه.
1. مثال 1
يوجد ترسب للنحاس في دائرة كهربائية بحجم 5 جرام. ما كتلة Ag التي ترسبت عند الأقطاب الكهربائية؟ للحصول على معلومات إضافية Ag = 108 ، و Cu = 63.5.
للحصول على صيغة حساب كتلة Ag أو Wاي جي يمكنك استخدام الصيغة التالية:
دبليوالنحاس = ليالنحاس
دبليواي جي= لياي جي
ME معروف بالمعادلة = أص
عدد الأكسدة = 2
معروف:
دبليوالنحاس = 5 جرام
احسب أولاً هامش الخطأ في المادتين باستخدام تفاعلات الاختزال لكل من Cu و Ag على النحو التالي:
النحاس2+ + 2 هـ– → النحاس (ق) ، MEcu
= أص = 63,5
عدد الأكسدة = 2
= 31,75
اي جي+ + ه– → Ag (s) MEاي جي
= أص = 108
عدد الأكسدة = 1
= 108
5gCu التالية = 31.75
دبليواي جي 108
= 17
إذن ، كتلة Ag التي تستقر تساوي 17 جرامًا.
2. مثال 2
كم عدد الفارادايس سوف يستغرق الأمر لتقليل أيونات الكالسيوم؟2+ بكمية 12 جرام؟ هنا المناقشة:
كاليفورنيا2+→ التكافؤ هو 2
Ar of Ca تساوي 40
الصيغة المستخدمة هي W = e x F
أين تجد F = W / e
الجواب هو:
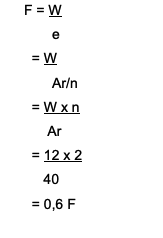
لذلك ، يتطلب الأمر 0.6 فاراداي لتقليل أيونات الكالسيوم2+ والتي تبلغ 12 جرام.
اقرأ: قانون كولوم
3. مثال 3
يُسمح بتدفق تيار كهربائي يبلغ 0.2 أمبير لمدة 50 دقيقة ، ثم يدخل في خلية التحليل الكهربائي التي تحتوي على محلول CuCl.2. ما مقدار راسب النحاس الذي سيتشكل عند الكاثود. كمعلومات إضافية Ar from Cu = 63.5
معروف:
التيار بالرمز I = 0.2 أمبير
الوقت مع الرمز t = 50 دقيقة ، إذا تم استخدامه على أنه ثواني فهو 50 × 60 ثانية ، أي 3000 ثانية
سئل: دبليوالنحاس?
الإجابة: اكتب أولاً تفاعل اختزال النحاس ، وهي:
النحاس2+ (عبد القدير) + 2 هـ+ → النحاس (ق)
أناالنحاس = أر
عدد الأكسدة = 63.5 / 2
= 31,75
الصيغة المستخدمة لإيجاد Wcu هو:
دبليوcu = (1/96500) x i x t x MEcu
= (1/96500) × 0.2 أمبير × 3000 ثانية × 31.75
= 0.197 جرام
لذلك ، فإن قيمة ترسب النحاس التي تحدث هي 0.197 جرام.
4. مثال 4
في التحليل الكهربائي باستخدام قطب كهربائي من النوع الكربوني ، كان قادرًا على إنتاج راسب من نوع النحاس بمقدار 12.7 جرامًا. يستخدم تيارًا كهربائيًا مقداره 4 أمبير. كم من الوقت سيستغرق التحليل الكهربائي؟
معروف:
Ar of Cu = 63.5
سئل: W؟
إجابه:

لذا فإن وقت التحليل الكهربائي هو 9650 ثانية باستخدام الصيغة التي تنطبق على قانون فاراداي.
لأولئك منكم الذين يدرسون الكيمياء ، بالطبع سوف تحتاج حقًا إلى فهم صحيح لقانون فاراداي. لذلك عند تكليفك بمهمة تتعلق بتطبيق القانون ، يمكنك الإجابة عليها بشكل صحيح وشامل باستخدام الصيغ المتاحة بالفعل.
X اغلاق
الإعلانات
الإعلانات
X اغلاق
