مادة الحل العازلة: المبادئ ، أنواع ، أمثلة على المشاكل
جار التحميل...
إحدى المواد التي تمت مناقشتها في الكيمياء هي محلول عازل يلعب دورًا مهمًا في تثبيت الأس الهيدروجيني ، سواء في الجسم أو في تفاعلات كيميائية معينة. يسمى هذا الحل أيضًا محلول عازلة أو محلول عازل.
غالبًا ما يتم دمج الحلول العازلة في المنتجات المستخدمة في الحياة اليومية. مثال بسيط هو قطرات العين التي لا تسبب إحساسًا بالوخز عند إسقاطها في العين. كيف حدث هذا؟ فيما يلي وصف مفصل لمحلول المخزن المؤقت.
قائمة المحتويات
تعريف محلول المخزن المؤقت

المحلول المنظم هو محلول لا يغير مستوى الأس الهيدروجيني على الإطلاق عند إضافته يخضع الماء لتغيير طفيف عند مزجه بالأحماض أو القواعد بتركيزات عالية قليل.
بمعنى آخر ، هذا المحلول المسمى بالمخزن له مستوى pH يميل إلى أن يكون مستقرًا على الرغم من إضافة سوائل أخرى إليه. على سبيل المثال ، سيبقى المحلول المنظم برقم هيدروجيني 5 عند نفس المستوى بعد خلطه بالماء.
عادةً ما يتغير المخزن المؤقت ذو الرقم الهيدروجيني 5 إلى مستوى 5.1 أو 4.9 بعد إضافة كمية صغيرة من محلول الحمض أو القاعدة. لذلك ، لا يوجد تغيير في مستويات الأس الهيدروجيني لتكون مرتفعة جدًا أو منخفضة جدًا.
خصائص محلول العازلة

تتمثل إحدى الطرق السهلة لتحديد وتمييز المخازن المؤقتة عن أنواع الحلول الأخرى في معرفة خصائصها. تتضمن بعض خصائص المخازن المؤقتة ما يلي:
- لديه القدرة على الحفاظ على الرقم الهيدروجيني الأولي على الرغم من إضافة حلول أخرى مثل الماء أو القواعد القوية أو الأحماض القوية بمستويات معينة ؛
- يمكن أن تحافظ على الرقم الهيدروجيني الأولي على الرغم من أن المحلول يخضع لعملية تخفيف ؛
- ستكون القدرة على الحفاظ على الرقم الهيدروجيني أكبر إذا كان بها عدد كبير من الشامات ؛
- قادرة على الحفاظ على قيمة Ka ، سواء عند درجة حرارة تتغير بشكل متكرر أو عند درجة حرارة ثابتة.
اقرأ: سائل
مبدأ الحل العازلة

يرجى ملاحظة أن المحاليل العازلة يتم تصنيفها إلى نوعين ، وهما المحاليل الحمضية والأساسية. ماذا يعني ذلك؟
- المخزن المؤقت للحمض هو نوع من المحلول مصنوع من خليط من حمض ضعيف وقاعدته المقترنة بحيث يكون فعالاً في الحفاظ على الرقم الهيدروجيني الأولي في الظروف الحمضية ؛
مثال على المخزن المؤقت الحمضي هو CH3COOH و CH3سجع– أو CH3COOH و CH3COONa و HF و NaF وكذلك NaH2ص4 و NaHPO4. - المخزن المؤقت الأساسي هو نوع من المحلول يأتي من قاعدة ضعيفة وحمضها المتقارن الذي يتم خلطه بحيث يكون قادرًا على الحفاظ على الرقم الهيدروجيني الأولي في الظروف القلوية.
مثال على المخزن المؤقت الأساسي هو N.2ح4 ون2ح5+ وكذلك NH3 و نيو هامبشاير4+.
الأحماض والقواعد الممزوجة مع اقتراناتها ستؤدي إلى توازن أيوني في الماء. نتيجة لذلك ، فإن المحلول المنظم قادر على الحفاظ على الأس الهيدروجيني ضمن نطاق معين دون تغيير الكثير.
ثم كيف تعمل؟ إليك توضيح بسيط للتوضيح:
- إذا كان الخليط ضعيف القواعد (NH4يضاف OH) وحمضه المتقارن إلى كمية صغيرة من القاعدة ، وسيحدث تفاعل بواسطة أيون OH.– والأيونات الموجبة من الحمض المترافق (NH4+);
- إذا كان خليط الأحماض الضعيفة (CH3COOH) وقاعدتها المقترنة (CH3سجع–) إلى كمية صغيرة نسبيًا من المحلول الحمضي ، يحدث تفاعل بين أيونات H.+ والأيونات السالبة من القاعدة المترافقة (CH3سجع–).
اقرأ: العناصر المتفاعلة
وظيفة حل المخزن المؤقت

في الحياة اليومية ، للمخازن المؤقتة استخدامات مهمة جدًا للبشر والنباتات. ما هي الوظائف المقصودة؟
- بالنسبة للنباتات ، تُستخدم المحاليل المعيارية لموازنة مستويات الأس الهيدروجيني في النباتات المزروعة باستخدام نظام الزراعة المائية. سيكون لمستويات الأس الهيدروجيني المتوازنة تأثير جيد على نمو النبات ؛
- بالنسبة للبشر ، تلعب المحاليل الوقائية دورًا في الحفاظ على درجة حموضة الدم دون تغيير. يتم الحفاظ على مستوى الأس الهيدروجيني في الدم بشكل صحيح بحيث تجري عمليات التمثيل الغذائي في الجسم بسلاسة. الأنواع هي عازلة الهيموغلوبين ، ومخزن الفوسفات ، ومخزن الكربونات ؛
- بالنسبة للبشر ، لا يزال للمخازن وظيفة أخرى ، وهي الحفاظ على مستوى ثابت للأس الهيدروجيني في الفم بحيث لا يسبب تسوس الأسنان. يتم إطلاق محلول الحفاظ على الرقم الهيدروجيني عن طريق اللعاب بحيث يمكن تحييد الحمض من الطعام الذي يدخل الفم.
سعة حل المخزن المؤقت

في الواقع ، يحتوي محلول المخزن المؤقت على سعة تُعرف أيضًا باسم كثافة المخزن المؤقت أو مؤشر المخزن المؤقت. سعة المخزن المؤقت هي مقياس يوضح قدرة المخزن المؤقت على الحفاظ على مستوى ثابت للأس الهيدروجيني عند مزجه بقاعدة قوية أو حمض قوي.
تتأثر شدة المخزن المؤقت بشكل كبير بكمية محتوى القواعد أو الأحماض في كل محلول. المحلول الذي يحتوي على أكبر سعة هو المحلول الذي يحتوي على كميات كبيرة من الأحماض أو الأملاح.
على سبيل المثال ، CH3COOH و CH3بلغ COONa سعة 2 مول أكبر من مزيج CH3COOH و CH3COONa التي تصل إلى 1 مول.
وفي الوقت نفسه ، إذا كان المحتوى صغيرًا ، تكون سعة التخزين المؤقت صغيرة أيضًا. سيعمل مؤشر المخزن المؤقت ذو المستوى العالي بشكل أكثر فعالية لتحييد الأحماض أو القواعد قبل حدوث تغيير كبير في الرقم الهيدروجيني.
بالإضافة إلى ذلك ، تتأثر السعة العازلة أيضًا بنسبة عدد مولات الملح الحمضي أو ملح القاعدة. مقارنة كبيرة ، بالطبع ، ينتج عنها عازلة تكون شدتها كبيرة أيضًا.
على سبيل المثال ، CH3COOH و CH3COONa التي تكون نسبتها 1: 1 (القيمة تساوي 1) أكبر من CH3COOH و CH3COONa نسبتها 1: 2 (تصبح القيمة 0.5).
اقرأ: صيغة الكثافة
صيغة محلول المخزن المؤقت

الإعلانات
كيف يتم حساب المخازن المؤقتة؟ هناك صيغة يجب تطبيقها لإجراء هذه الحسابات. يتم تقسيم الصيغة إلى قسمين هما المخزن المؤقت الحمضي الخاص والمخزن القلوي.
أولاً ، تكون صيغة محلول المخزن المؤقت للحمض كما يلي:

يشير كا إلى ثابت التوازن الحمضي
V هو التكافؤ وهو مقدار المحتوى الأيوني الضعيف للقاعدة المترافقة
ثانيًا ، صيغة المحلول القلوي العازل هي:
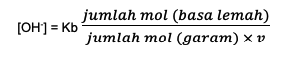
Kb ثابت التوازن الأساسي
V هو التكافؤ وهو كمية الحمض المترافق أو محتوى الأيون الضعيف
أمثلة على مشاكل حل العازلة ومناقشتها

إليك مثال على سؤال لتحسين فهمك للمخازن المؤقتة:
1. محلول CH3تمت إضافة COOH 0.1 M ، Ka (10-5) بقدر 200 مل إلى محلول CH3أيضا 200 مل من 0.1 مولار كونا ، فما هو الرقم الهيدروجيني للخليط؟
الخطوة الأولى هي حساب مولات كل حل أولاً:
الخلد CH3COOH = m v = 0.1 200 = 20 ملي مول
الخلد CH3COONa = m v = 0.1 200 = 20 ملي مول
ثم ، مباشرة في صيغة المخزن المؤقت للحمض:

بناءً على هذه الحسابات ، فإن تركيز أيونات H.+ معروف بالفعل هذا هو. بعد ذلك ، أدخل العملية الحسابية للعثور على الرقم الهيدروجيني ، وهو:
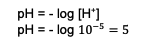
لذلك ، فإن الرقم الهيدروجيني للخليط الناتج هو 5.
2. NH. الحل3 0.1 م كيلوبايت (10-5) بمقدار 400 مل ممزوج بمحلول NH44Cl 0.1 M بقدر 200 مل. نحدد درجة حموضة الخليط الذي يظهر بسبب الخليط!
الخطوة الأولى هي معرفة مولات المحلول وهي:
مولات NH3 = م ع = 0.1 400 = 40 مليمول
مولات NH4Cl = m v = 0.1 200 = 20 ملي مول
بعد ذلك ، استخدم صيغة المخزن الأساسي لتحديد تركيز أيونات OH– والتي سيتم استخدامها لحساب الرقم الهيدروجيني لاحقًا.

بعد ذلك ، أدخل في حساب الأس الهيدروجيني للخليط ، وهي:
pOH = - سجل [OH–] = 5 - سجل 4
الرقم الهيدروجيني = 14 - pOH
الرقم الهيدروجيني = 14 - (5 - السجل 4) = 9 + السجل 4
استنتاج
العازلة عبارة عن محلول قادر على الحفاظ على مستوى الأس الهيدروجيني الأولي في نطاق معين بعد إضافته بكمية صغيرة من محلول الحمض أو القاعدة. هناك نوعان ، وهما عازلة حمضية من حمض ضعيف وملحها وعازل قلوي من قاعدة ضعيفة وملحها.
من المهم التعرف على الحلول العازلة التي لها وظيفة في الحياة. لا تفهم مبدأ العمل فحسب ، بل تعرف أيضًا على الرقم الهيدروجيني لمزيج المخزن المؤقت الذي تم تكوينه والتفاعل الحمضي القاعدي لتشكيل المخزن المؤقت.
X اغلاق
الإعلانات
الإعلانات
X اغلاق
